En étudiant la branche de la chimie organique, vous avez peut-être rencontré les termes « acétone » et « acide acétique ». Il existe cependant une question académique quant à la différenciation des deux.
Ce sont tous deux des liquides incolores, ayant différents types d'odeurs. Ils sont également utilisés dans différentes industries et ont leurs propres modes de préparation.
Faits marquants
- L'acétone est un composé organique incolore, hautement inflammable et volatil utilisé comme solvant, tandis que l'acide acétique est un acide organique faible qui donne au vinaigre son goût aigre.
- L'acétone est utilisée comme solvant dans de nombreuses industries, telles que les dissolvants pour vernis à ongles, tandis que l'acide acétique est utilisé pour fabriquer du plastique et d'autres produits chimiques.
- L'acétone a une odeur caractéristique et inflammable, tandis que l'acide acétique a une odeur piquante et corrosive.
Acétone vs acide acétique
La différence entre acétone et l'acide acétique réside principalement dans leur composition et leur formule. Alors que l'acétone est constituée d'une molécule de cétone, l'acide acétique est considéré comme constitué d'une molécule d'acide carboxylique.

Tableau de comparaison
| Paramètres de comparaison | Acétone | Acide acétique |
|---|---|---|
| Laits en poudre | La formule chimique de l'acétone est CH3COCH3 | La formule chimique de l'acide acétique est CH3COOH |
| Odeur | L'acétone a une odeur qui ressemble à celle d'un fruit. | L'acide acétique a une odeur similaire à celle du vinaigre. |
| Type de molécule | L'acétone provient d'un type de molécule de cétone | L'acide acétique provient d'un type d'acide carboxylique. |
| La masse moléculaire | Le poids moléculaire de l'acétone est de 58.08 g/mol. | Le poids moléculaire de l'acide acétique est de 60.052 g/mol |
| PH | L'acétone est basique. C'est pourquoi son pH est de 7 | L'acide acétique est acide et son pH est de 2.4. |
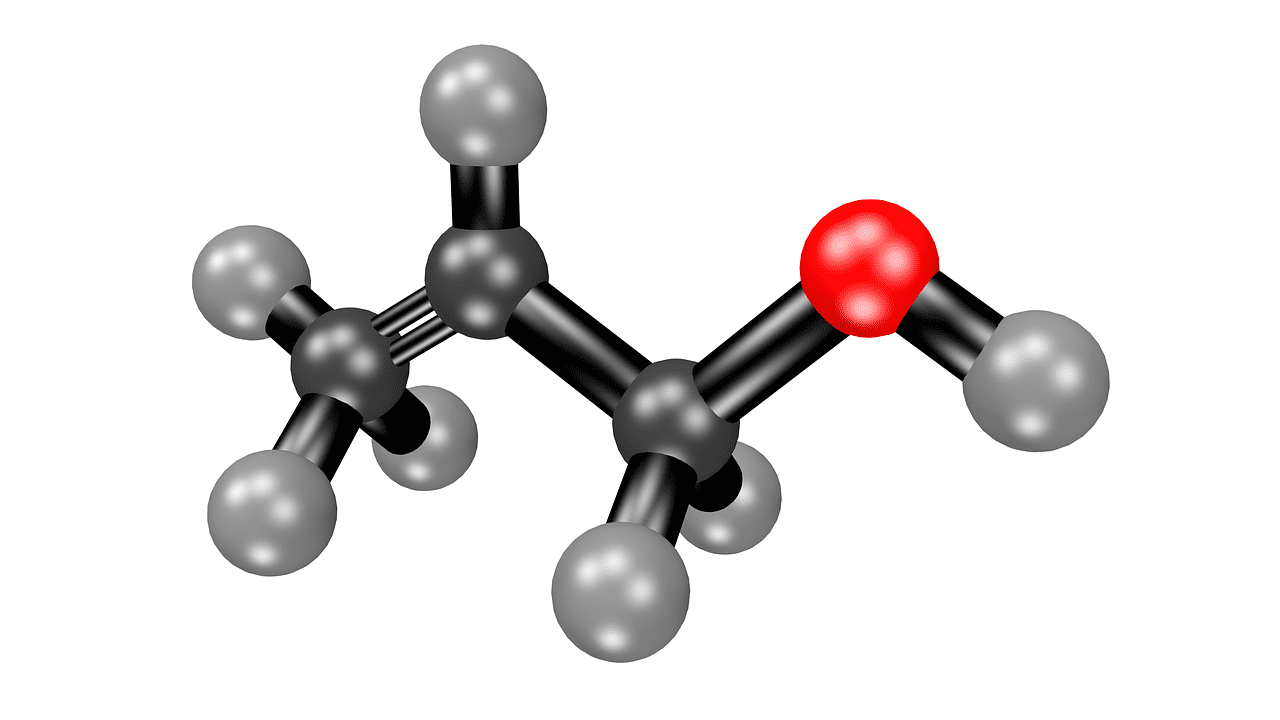
Qu'est-ce que l'acétone ?
L'acétone, ou propanone, est un liquide chimique sans aucune couleur.
L'acétone a un rôle énorme à jouer dans la chimie organique. Il est volatil et sent aussi celui d'un fruit. Il joue principalement le rôle de solvant et peut être mélangé à de l'eau.
Il vient du groupe des cétones avec la formule chimique- (CH3)2CO.
Il a une large gamme d'utilisations dans l'industrie. Il aide à la fabrication du plastique et peut même être tenu responsable de divers travaux ménagers. Vous avez peut-être entendu le nom des dissolvants pour vernis à ongles.
L'acétone est en effet l'ingrédient clé pour enlever le vernis de vos ongles.
Il est également utilisé pour fabriquer des cosmétiques et d'autres produits dans notre ménage quotidien.
Le corps humain peut également produire lui-même de l'acétone par métabolisme. L'urine et le sang humains contiennent de l'acétone.
L’acétone étant légère et pouvant s’évaporer rapidement, elle est utilisée pour le nettoyage. Vous pouvez le tamponner rapidement avec un chiffon fin ou du coton ; la solution est prête !
Il a diverses utilisations dans le textile ainsi que dans l'industrie automobile. Les meubles en bois et les automobiles sont finis avec un revêtement appelé laques. L'ingrédient clé de ces laques est l'acétone elle-même.
Il n'est pas aussi toxique que certains produits chimiques. Mais, nous devons maintenir certaines précautions de sécurité lorsque nous travaillons avec. Étant inflammable, vous devez en prendre soin lorsque vous travaillez avec de l'acétone.
De plus, vous pourriez tousser si vous sentez accidentellement de l'acétone.
Qu'est-ce que l'acide acétique?
L'acide acétique est présent dans la nature. Vous pourriez également trouver de l'acide acétique dans les animaux et les plantes.
Comme l'acétone, il est assez important en chimie organique, et CH3COOH est la formule chimique de l'acide acétique. IUPAC, ou le nom plus formel de l'acide acétique, est Acide éthanoique.
Il est acide et a une odeur semblable à celle du vinaigre. Habituellement, ces deux facteurs servent également d'identificateurs dans le cas de l'acide acétique.
Il provient d’un acide carboxylique et est considéré comme le plus simple de la famille.
Industriellement, il est préparé à partir de méthanol par un procédé appelé carbonylation.
Bien qu'il n'ait pas de couleur comme l'acétone, l'odeur du vinaigre est la façon dont nous pouvons le distinguer.
L'acide acétique possède de nombreuses propriétés pour lesquelles il est utile dans divers domaines. Initialement, il peut tuer les germes et les bactéries, pour lesquels il agit comme antiseptique. Il est également antibactérien.
Une utilisation industrielle serait l'aide de l'acide acétique dans la préparation des fibres, en particulier rayonne fibres. Vous pouvez même utiliser l’acide acétique dans le traitement des cellules cancéreuses. Les médecins utilisent de l’acide acétique pour l’injecter dans les cellules endommagées.
Le vinaigre est essentiellement de l'acide acétique. Pour cette raison, l'acide acétique est utilisé dans la conservation des légumes. L'ingrédient clé dans la préparation des caoutchoucs se trouve également être l'acide acétique.
Plusieurs parfums contiennent également de l'acide acétique dans leurs proportions.
Le monomère d'acétate de vinyle est produit à l'aide d'acide acétique.
Il peut être mélangé dans l'eau assez rapidement. Il réagit aussi bien avec les polaires qu'avec non polaire substances. Utilisé dans diverses industries, l'acide acétique est un produit chimique très important dans la vie quotidienne.
Principales différences entre l'acétone et l'acide acétique
- L'acétone est une substance chimique qui provient d'une cétone, et CH3COCH3 est la formule chimique de cette substance. L'acide acétique est également une substance chimique, mais il provient d'un acide carboxylique. CH3COOH est la formule chimique de cette substance.
- Ces deux produits chimiques peuvent être trouvés dans la nature. Ils sont soit produits dans le corps humain, soit naturellement par certaines bactéries. L'acétone peut être créée dans le corps humain via le métabolisme. Lorsque les graisses sont décomposées, de l'acide acétique est produit. D'autre part, l'acide acétique peut être produit par une bactérie appelée Acetobacter par fermentation.
- Les deux substances peuvent également être produites en laboratoire. Il existe des moyens artificiels pour produire ces deux. La fabrication d'acide acétique dans une méthode artificielle est connue sous le nom d'hydroperoxyde de cumène. D'autre part, l'acide acétique peut être produit par la fusion de dioxyde de carbone et de méthanol.
- L'acétone enlève la peinture des ongles, tandis que l'acide acétique peut fabriquer des plastiques.
- L'acétone peut également être utilisée dans le décapage des peintures de manière industrielle. D'autre part, l'acide acétique est utilisé pour conserver les légumes par marinage.

Dernière mise à jour : 11 juin 2023

Piyush Yadav a passé les 25 dernières années à travailler comme physicien dans la communauté locale. C'est un physicien passionné par l'idée de rendre la science plus accessible à nos lecteurs. Il est titulaire d'un baccalauréat en sciences naturelles et d'un diplôme d'études supérieures en sciences de l'environnement. Vous pouvez en savoir plus sur lui sur son page bio.

Je me demande si nous devrions être plus prudents en manipulant ces produits chimiques. Il semble qu’ils puissent aussi être risqués.
C'est vrai! Il est toujours important de prendre des mesures de sécurité lors de la manipulation de ces produits chimiques.
Je pense que les risques ne doivent pas être négligés.
L'article propose une excellente comparaison de l'acétone et de l'acide acétique, très bien détaillée.
Oui, les détails sont très bien expliqués ici.
Tout à fait d'accord, les détails sont très instructifs.
Cet article fournit une comparaison informative entre l’acétone et l’acide acétique. Il est bénéfique de comprendre leurs différences.
Je ne pourrais pas être plus d'accord.
Absolument, il est toujours bon d’avoir une compréhension claire de ces composés.
Je trouve drôle de voir comment le corps humain produit de l'acétone et son importance pour nos produits ménagers.
C'est effectivement assez amusant !
L'acétone et l'acide acétique sont des produits chimiques essentiels dans de nombreuses industries. C'est incroyable de voir à quel point ils sont polyvalents !
Ils le sont vraiment, ces produits chimiques contiennent bien plus qu’on ne le pense.
Absolument! La polyvalence de ces produits chimiques est fascinante.
Le contenu informatif aide à comprendre les utilisations et les dangers potentiels de l’acétone et de l’acide acétique.
Il est essentiel d'être conscient des dangers de ces produits chimiques pour être prudent.
Absolument, l’importance d’une utilisation appropriée de ces produits chimiques ne peut être surestimée.
Cet article détaille bien les différentes qualités et utilisations de l’acétone et de l’acide acétique.
Un article assez informatif sur le sujet.
Oui, une comparaison détaillée de ces produits chimiques.
L'article est une bonne source pour comprendre les propriétés et les utilisations de l'acétone et de l'acide acétique.
En effet, une excellente lecture pour ceux qui s'intéressent à la chimie.
Très instructif, en effet.
Un article assez intéressant sur ces composés organiques, une bonne lecture.
Un article intéressant et informatif certainement.
En effet, une bonne lecture.
Il est intéressant de voir comment ces deux composés organiques sont utilisés différemment malgré leurs similitudes. Ils semblent plutôt inoffensifs compte tenu de leurs diverses utilisations.
Oui, ces composés sont vraiment intéressants à étudier !
Tout à fait d'accord!