La tavola periodica della chimica è qualcosa che agli studenti viene chiesto di memorizzare noiosamente senza nemmeno conoscere il vero motivo dietro l'apprendimento. Per alcune persone, è solo un argomento incluso nel loro programma.
Ma in realtà, questa piccola tavola periodica è molto più importante di così; è una tabella di marcia che sblocca un milione di opportunità per scienziati e ricercatori in tutto il mondo. Dmitri Mendeleyev è l'inventore della tavola periodica.
Prima di lui, molti si sono sforzati di organizzare gli elementi chimici in modi diversi. Ma il risultato di Dmitri è stato accettato in tutto il mondo.
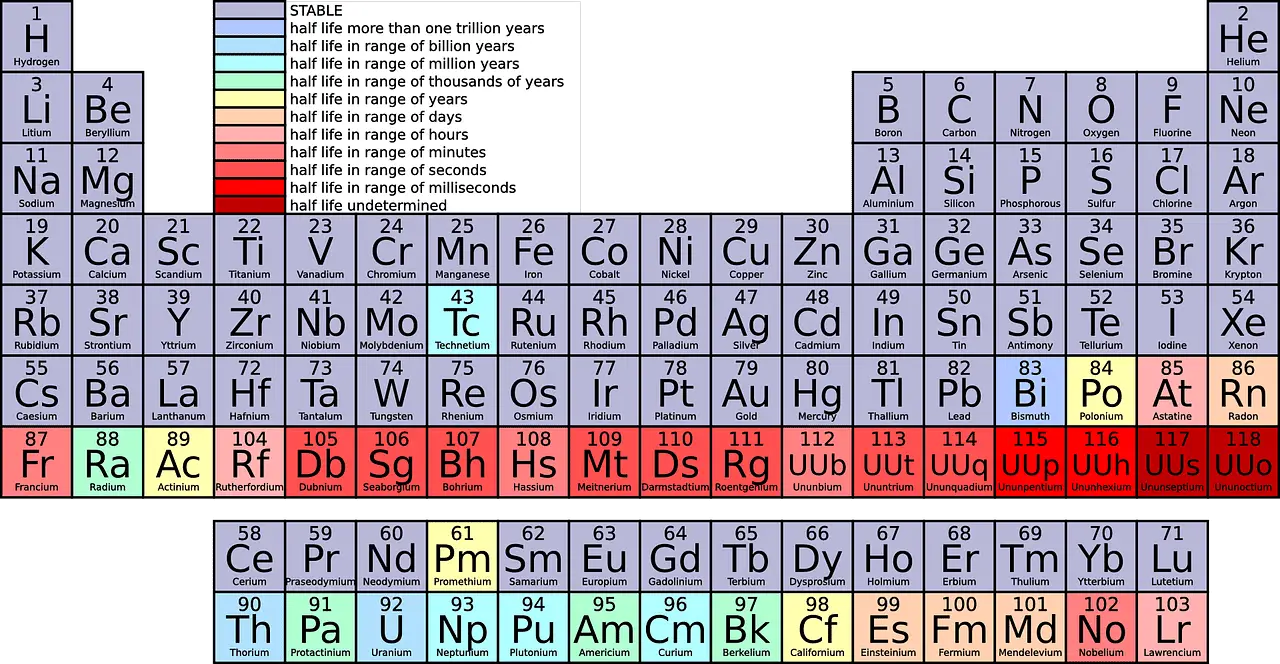
Nelle abbreviazioni scientifiche, le righe sono indicate rispettivamente come Periodi e le colonne come Gruppi.
Punti chiave
- I periodi sono le righe orizzontali nella tavola periodica, che indicano il numero di gusci di elettroni negli atomi di un elemento, con elementi nello stesso periodo che hanno strutture atomiche simili.
- I gruppi sono le colonne verticali nella tavola periodica, costituite da elementi con lo stesso numero di elettroni nel loro guscio esterno, che porta a proprietà chimiche simili.
- Sia i periodi che i gruppi organizzano gli elementi nella tavola periodica, con periodi che rappresentano righe orizzontali basate su gusci di elettroni e gruppi che rappresentano colonne verticali basate su elettroni di guscio esterno e proprietà chimiche.
Periodo vs Gruppo
Un periodo è una riga orizzontale che va dal lato sinistro al lato destro della tavola periodica e l'elettronegatività aumenta attraverso di essa. Un gruppo è una verticale colonna che va dall'alto verso il basso della tavola periodica e l'elettronegatività aumenta dal basso verso l'alto.

Durante il periodo di arrangiamento, Mendeleyev ha lasciato alcune file vuote con l'impressione che altri elementi sarebbero entrati nel prossimo futuro. E sorprendentemente, uno degli elementi che si adattava a quella lacuna lo era Gallio.
Tavola di comparazione
| Parametro di confronto | Periodo | Gruppo |
|---|---|---|
| Tipo di viaggio | I periodi sono le righe orizzontali della moderna tavola periodica | I gruppi sono le colonne verticali che attraversano la parte superiore della tavola periodica |
| Properties | Gli elementi in un periodo non hanno proprietà simili. | Gli elementi in ogni gruppo hanno proprietà simili ma proprietà non identiche. |
| somiglianza | Gli elementi nello stesso periodo hanno un numero uguale di composizione elettronica | Gli elementi di ciascun gruppo hanno un numero uguale di elettroni di valenza |
| Somma | Ci sono 7 periodi nella tavola periodica | Il gruppo contiene 18 elementi disposti verticalmente nella moderna tavola periodica. |
| Elettronegatività | Aumenta da sinistra a destra. | Aumenta dal basso verso l'alto in un gruppo. |
Cos'è il periodo?
Un periodo è una riga orizzontale dall'estrema sinistra all'estrema destra della tavola periodica. A partire da ora, ci sono 7 periodi nella tavola periodica.
Inizia un nuovo periodo quando un nuovo livello di energia fondamentale si somma agli elettroni. Ogni elemento in un periodo avrà probabilmente un numero uguale di orbitali atomici.
Ad esempio, ogni elemento in 1st il periodo ha solo 1 orbitale per i suoi elettroni, 2nd periodo include 2 orbitali per gli elettroni. Allo stesso modo, gli orbitali continuano a sommarsi man mano che scendi nella riga.
La dimensione dell'elemento diminuisce mentre ci si sposta attraverso un periodo poiché il numero di gusci di elettroni rimane costante, ma il numero di protoni aumenta nel nucleo. Questo è il motivo per cui l'atomo diventa più pesante, ma la dimensione continua a diminuire.
Guardando la tavola periodica, vedresti diversi elementi inseriti in ogni riga. Il 1° periodo ha solo 2 elementi (1 e 18), il 2° e il 3° periodo hanno 8 elementi ciascuno, il 4° e il 5° periodo hanno 18 elementi e il 6° e il 7° periodo hanno rispettivamente 32 elementi.
Che cos'è il gruppo?
Contando dall'alto verso il basso, ci sono 18 gruppi nella tavola periodica. A tutti i gruppi sono assegnati nomi distinti.
I gruppi sono categorie miste di metalli, non metalli e semimetalli, raggruppati in famiglie in base alle loro proprietà simili. Ad esempio, il gruppo 1 appartiene alla famiglia del litio, classificato come metalli alchenici.
Allo stesso modo, ogni gruppo nella corsia ha il proprio cognome. Gli elementi nel gruppo correlato hanno tratti simili perché hanno lo stesso numero di elettroni nei loro gusci più esterni.
La dimensione dell'elemento aumenta man mano che sposti qualsiasi gruppo verso il basso. Questo perché nel nucleo esiste un gran numero di protoni e neutroni.
Inoltre, un guscio di elettroni in più rende l'atomo più pesante. Per i gruppi, ci sono due modi diversi per illustrare gli elementi.
Comprendere entrambi i sistemi di numerazione è essenziale perché la tavola periodica appare in entrambi i formati. Negli Stati Uniti si usavano le lettere A&B per indicare ogni elemento del gruppo, ma sfortunatamente si osservava un sistema di numerazione disorganizzato.
Per eliminare ogni possibile confusione, l'Internazionale Unione di Chimica Pura e Applicata (IUPAC) ha avuto l'idea di numerare gli elementi come (1,2, 3… 18). Tuttavia, entrambi i sistemi di numerazione sono accettabili. Ma la numerazione IUPAC sembra ben organizzata e semplice.
Principali differenze tra Periodo e Gruppo
- Sede: I gruppi sono la colonna verticale, mentre i periodi sono le righe diritte nella tavola periodica.
- Numero: Ci sono un totale di 18 gruppi e 7 periodi nella tavola periodica, tra i quali i gruppi sono classificati in diverse famiglie e tipi di metallo.
- Proprietà chimiche: Tutti gli elementi del gruppo hanno proprietà chimiche o fisiche analoghe, mentre i periodi condividono la stessa gerarchia elettronica.
- Livello di energia: Man mano che scendiamo nel gruppo dall'alto verso il basso, il livello di energia degli elettroni aumenta. D'altra parte, in ogni periodo, il livello di energia dell'elettrone rimane lo stesso.
- Elettronegatività: Questo diminuisce dall'alto verso il basso in un gruppo e sale da sinistra a destra in un periodo. Questa è una considerazione essenziale durante lo studio della tavola periodica.

Ultimo aggiornamento: 11 giugno 2023

Piyush Yadav ha trascorso gli ultimi 25 anni lavorando come fisico nella comunità locale. È un fisico appassionato di rendere la scienza più accessibile ai nostri lettori. Ha conseguito una laurea in scienze naturali e un diploma post-laurea in scienze ambientali. Puoi leggere di più su di lui sul suo pagina bio.

Ottimo articolo! Ciò fornisce una visione approfondita dell’importanza della tavola periodica. Mi sono davvero divertito!
Sono molto felice che tu l'abbia trovato utile. L'ho fatto anch'io!
Assolutamente, ogni studente di scienze dovrebbe leggerlo.
Post molto informativo Dovremmo spingere per una migliore istruzione e comprensione degli argomenti scientifici.
Questo è esattamente ciò di cui abbiamo bisogno.
Questo è solo un altro esempio di standard educativi obsoleti. Dovremmo insegnare argomenti più rilevanti agli studenti.
Credo che sia di vitale importanza per gli studenti comprendere la tavola periodica.
È un'interpretazione controversa, Joel.
Penso che le persone sottovalutino il valore della tavola periodica. Dovremmo fare di più per migliorare il nostro insegnamento.
Assolutamente, questo è un punto importante.
Penso che sia davvero interessante che una tabella così apparentemente semplice possa contenere così tante informazioni preziose.
Sì, è piuttosto affascinante.
Questo è illuminante. La tavola periodica è sottostimata.
Questa era una lettura tanto necessaria per iniziare la mia giornata!
Alcuni punti validi presentati qui, ma non sono ancora convinto dell'importanza della tavola periodica.
Sono d'accordo con te, Zach.
La tavola periodica è una pietra miliare della chimica e dovrebbe essere trattata come tale.
Non potrei essere più d'accordo.
Non sono d'accordo, credo che insegnare la tavola periodica nella maniera attuale sia superato e vada rivisto.
Capisco perché alcuni potrebbero trovarlo obsoleto, ma è davvero vitale per lo sviluppo scientifico.
Capisco quello che dici ma non sono completamente d'accordo.
Pur comprendendo l’importanza della tavola periodica, è difficile sostenere che l’attuale sistema educativo sia adeguato.
Hai sollevato un punto importante, Erin.