Ķīmijas periodiskā tabula ir kaut kas tāds, kas studentiem tiek lūgts nogurdinoši iegaumēt, pat nezinot patieso motīvu tās apguvei. Dažiem cilvēkiem tā ir tikai tēma, kas iekļauta mācību programmā.
Bet reālā nozīmē šī mazā periodiskā tabula ir daudz svarīgāka par to; tas ir ceļvedis, kas atklāj miljoniem iespēju zinātniekiem un pētniekiem visā pasaulē. Dmitrijs Mendeļejevs ir periodiskās tabulas izgudrotājs.
Pirms viņa daudzi centās dažādos veidos sakārtot ķīmiskos elementus. Bet Dmitrija iznākums tika pieņemts visā pasaulē.
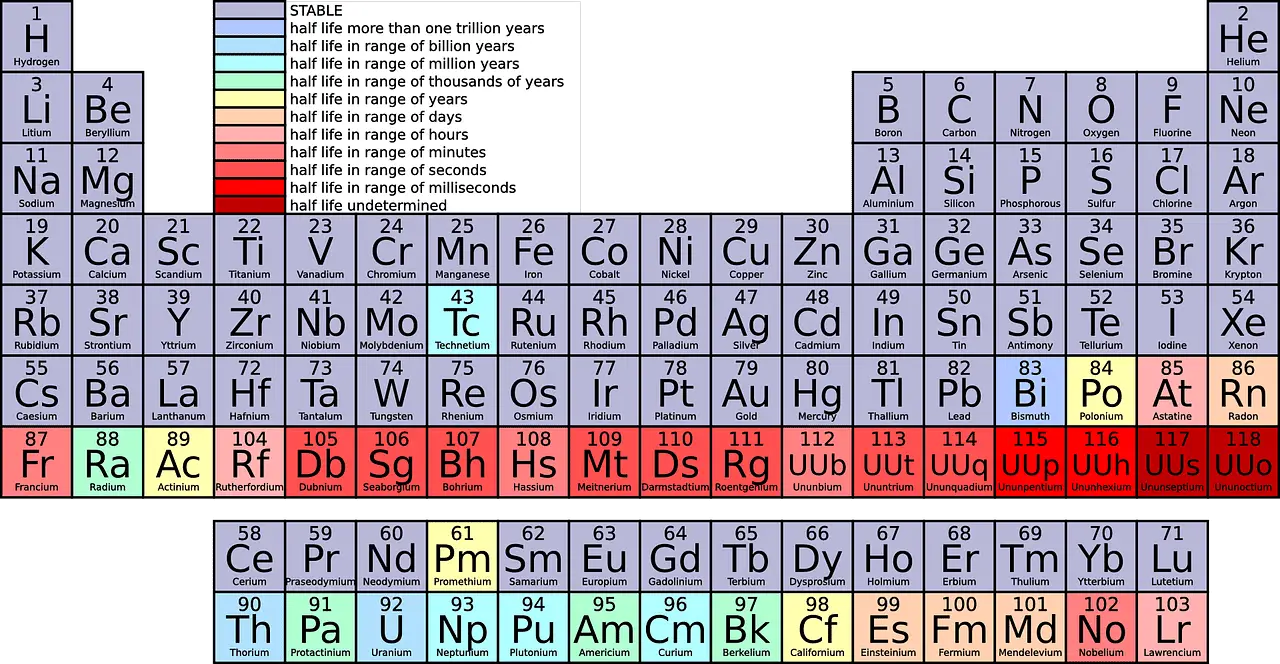
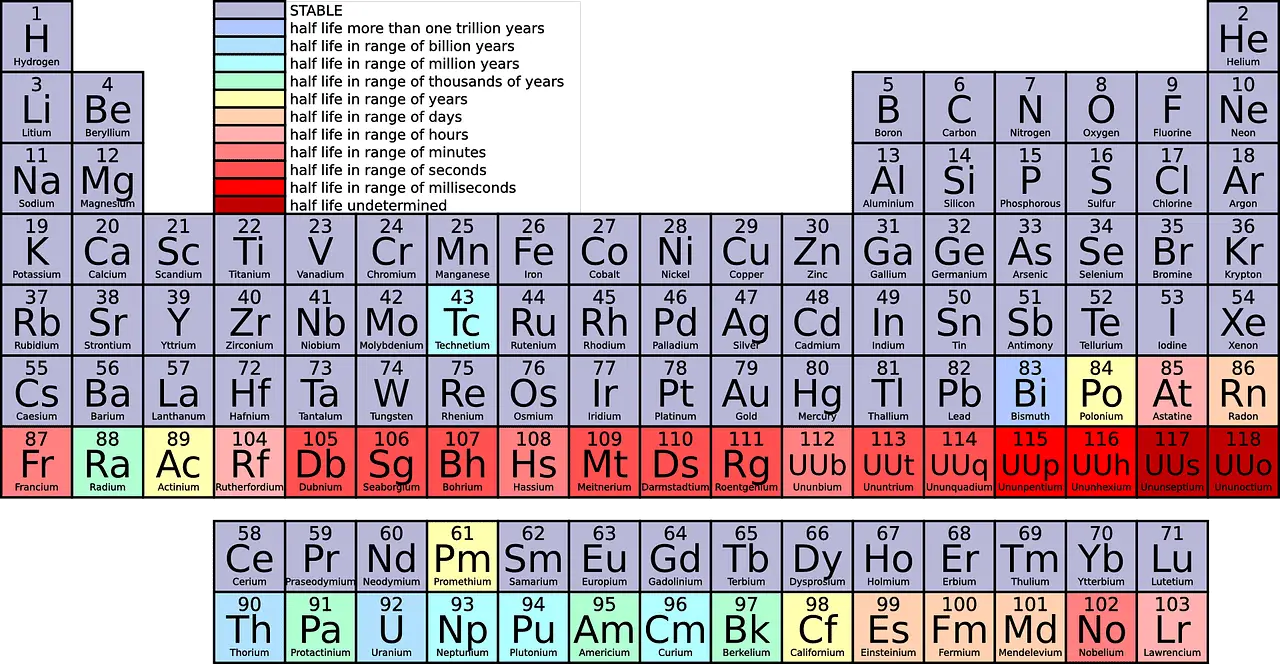
Zinātniskajos saīsinājumos rindas attiecīgi tiek sauktas par periodiem un kolonnas par grupām.
Atslēgas
- Periodi ir periodiskās tabulas horizontālās rindas, kas norāda elektronu apvalku skaitu elementa atomos, un elementiem tajā pašā periodā ir līdzīgas atomu struktūras.
- Grupas ir periodiskās tabulas vertikālās kolonnas, kas sastāv no elementiem, kuru ārējā apvalkā ir vienāds elektronu skaits, kas rada līdzīgas ķīmiskās īpašības.
- Gan periodi, gan grupas organizē elementus periodiskajā tabulā, un periodi attēlo horizontālās rindas, kuru pamatā ir elektronu apvalki, un grupas, kas attēlo vertikālas kolonnas, pamatojoties uz ārējā apvalka elektroniem un ķīmiskajām īpašībām.
Periods pret grupu
Periods ir horizontāla rinda, kas iet no periodiskās tabulas kreisās puses uz labo pusi, un visā tajā palielinās elektronegativitāte. Grupa ir vertikāle sleja kas iet no periodiskās tabulas augšdaļas uz leju, un elektronegativitāte palielinās no apakšas uz augšu.

Sakārtošanas laikā Mendeļejevs atstāja dažas rindas tukšas ar iespaidu, ka tuvākajā laikā ienāks vēl kādi elementi. Un pārsteidzoši, ka viens no elementiem, kas ietilpa šajā spraugā, bija gallijs.
Salīdzināšanas tabula
| Salīdzināšanas parametrs | periods | grupa |
|---|---|---|
| Vadība | Periodi ir horizontālās rindas mūsdienu periodiskajā tabulā | Grupas ir vertikālās kolonnas, kas iet cauri periodiskās tabulas augšdaļai |
| Rekvizīti | Perioda elementiem nav līdzīgu īpašību. | Katras grupas elementiem ir dažas līdzīgas īpašības, bet ne identiskas īpašības. |
| Līdzība | Elementiem tajā pašā periodā ir vienāds elektronu sastāva skaits | Katras grupas elementiem ir vienāds valences elektronu skaits |
| Summa | Periodiskajā tabulā ir 7 periodi | Grupa satur 18 elementus, kas modernajā periodiskajā tabulā sakārtoti vertikāli. |
| Elektronegativitāte | Tas palielinās no kreisās puses uz labo. | Grupā tas palielinās no apakšas uz augšu. |
Kas ir Periods?
Periods ir periodiskās tabulas horizontāla rinda no galējās kreisās puses uz galējo labo pusi. Šobrīd periodiskajā tabulā ir 7 periodi.
Sākas jauns periods, kad ar elektroniem pievienojas jauns fundamentālās enerģijas līmenis. Katram elementam periodā, iespējams, būs vienāds skaits atomu orbitāļu.
Piemēram, katrs elements 1st periodam ir tikai 1 orbitālās tā elektroniem, 2nd periods ietver 2 orbitāles elektroniem. Tāpat orbitāles turpina palielināties, virzoties uz leju rindā.
Elementa izmērs samazinās, pārvietojoties pa periodu, jo elektronu apvalku skaits paliek nemainīgs, bet protonu skaits kodolā palielinās. Tāpēc atoms kļūst smagāks, bet izmērs turpina samazināties.
Aplūkojot periodisko tabulu, jūs redzēsit dažādus elementus, kas ievietoti katrā rindā. 1. periodam ir tikai 2 elementi (1 un 18), 2. un 3. periodam ir 8 elementi, 4. un 5. periodam ir 18 elementi, un 6. un 7. periodam ir attiecīgi 32 elementi.
Kas ir grupa?
Skaitot no augšas uz leju, periodiskajā tabulā ir 18 grupas. Visām grupām ir piešķirti atšķirīgi nosaukumi.
Grupas ir jauktas metālu, nemetālu un pusmetālu kategorijas, kas sagrupētas ģimenēs pēc to līdzīgām īpašībām. Piemēram, 1. grupa pieder pie litija saimes, kas klasificēta kā alkēnmetāli.
Tāpat katrai joslas grupai ir savs uzvārds. Saistītās grupas elementiem ir līdzīgas iezīmes, jo tiem ir vienāds elektronu skaits attālākajos apvalkos.
Elementa lielums palielinās, pārvietojot jebkuru grupu uz leju. Tas ir tāpēc, ka kodolā ir liels skaits protonu un neitronu.
Papildus tam papildu elektronu apvalks padara atomu smagāku. Grupām ir divi dažādi veidi, kā ilustrēt elementus.
Abu numerācijas sistēmu izpratne ir būtiska, jo periodiskā tabula parādās abos formātos. Amerikas Savienotajās Valstīs viņi izmantoja burtus A&B, lai norādītu katru grupas elementu, taču diemžēl tā tika novērota kā nesakārtota numerācijas sistēma.
Lai novērstu visas iespējamās neskaidrības, Starptautiskais Savienība Pure and Applied Chemistry (IUPAC) nāca klajā ar ideju numurēt elementus kā (1,2, 3…18). Tomēr abas numerācijas sistēmas ir pieņemamas. Taču IUPAC numerācija izskatās labi organizēta un vienkārša.
Galvenās atšķirības starp Periods un grupa
- Atrašanās vieta: Grupas ir vertikālā kolonna, savukārt periodi ir taisnās rindas periodiskajā tabulā.
- Numurs: Periodiskajā tabulā kopā ir 18 grupu skaits un 7 periodi, starp kuriem grupas ir iedalītas dažādās ģimenēs un metālu veidos.
- Ķīmiskās īpašības: Visiem grupas elementiem ir līdzīgas ķīmiskās vai fizikālās īpašības, savukārt periodiem ir tāda pati elektronu hierarhija.
- Enerģijas līmenis: Kad mēs ejam pa grupu no augšas uz leju, elektronu enerģijas līmenis palielinās. No otras puses, katrā periodā elektronu enerģijas līmenis paliek nemainīgs.
- Elektronegativitāte: Tas samazinās no augšas uz leju grupā un palielinās no kreisās uz labo pusi periodā. Tas ir būtisks apsvērums, pētot periodisko tabulu.

Pēdējo reizi atjaunināts: 11. gada 2023. jūnijā

Pijušs Jadavs pēdējos 25 gadus ir pavadījis, strādājot par fiziķi vietējā sabiedrībā. Viņš ir fiziķis, kurš aizrautīgi cenšas padarīt zinātni pieejamāku mūsu lasītājiem. Viņam ir bakalaura grāds dabaszinātnēs un pēcdiploma diploms vides zinātnē. Vairāk par viņu varat lasīt viņa vietnē bio lapa.

Lielisks raksts! Tas sniedz lielisku priekšstatu par periodiskās tabulas nozīmi. Man ļoti patika!
Es ļoti priecājos, ka jums tas noderēja. Es arī darīju!
Tas noteikti ir jāizlasa katram zinātņu studentam.
Ļoti informatīvs ieraksts. Mums jācenšas panākt labāku izglītību un izpratni par zinātnes tēmām.
Tas ir tieši tas, kas mums vajadzīgs.
Šis ir tikai vēl viens novecojušu izglītības standartu piemērs. Mums vajadzētu mācīt skolēniem atbilstošākas tēmas.
Es uzskatu, ka studentiem ir ļoti svarīgi saprast periodisko tabulu.
Tas ir pretrunīgs viedoklis, Džoel.
Es domāju, ka cilvēki par zemu novērtē periodiskās tabulas vērtību. Mums vajadzētu darīt vairāk, lai uzlabotu mūsu mācīšanu par to.
Protams, tas ir svarīgs punkts.
Manuprāt, ir patiešām interesanti, ka tik šķietami vienkāršā tabulā var būt tik daudz vērtīgas informācijas.
Jā, tas ir diezgan aizraujoši.
Tas ir apgaismojoši. Periodiskā tabula ir nepietiekami novērtēta.
Šī bija ļoti vajadzīga lasāmviela, lai sāktu manu dienu!
Šeit ir sniegti daži derīgi punkti, taču es joprojām neesmu pārliecināts par periodiskās tabulas nozīmi.
Es tev piekrītu, Zach.
Periodiskā tabula ir ķīmijas stūrakmens, un tā ir jāizturas kā tāda.
Es nevarētu vienoties vairāk.
Es nepiekrītu, es uzskatu, ka periodiskās tabulas mācīšana pašreizējā veidā ir novecojusi un būtu jāpārskata.
Es saprotu, kāpēc dažiem tas varētu šķist novecojis, taču tas patiešām ir ļoti svarīgi zinātnes attīstībai.
Es saprotu, ko jūs sakāt, bet es pilnībā nepiekrītu.
Lai gan es saprotu periodiskās tabulas nozīmi, ir grūti apgalvot, ka pašreizējā izglītības sistēma ir atbilstoša.
Jūs izvirzījāt svarīgu jautājumu, Erin.