Периодични систем хемије је нешто што се од ученика тражи да заморно памте, а да чак и не знају стварни мотив иза учења. За неке људе, то је само тема укључена у њихов наставни план.
Али у правом смислу, ова мала периодична табела је много важнија од тога; то је путоказ који отвара милион могућности за научнике и истраживаче широм света. Дмитриј Мендељејев је проналазач периодног система.
Пре њега, многи су се трудили да распореде хемијске елементе на различите начине. Али Дмитријев исход је прихваћен широм света.
У научним скраћеницама, редови се називају периодима, а колоне групе.
Кључне Такеаваис
- Периоди су хоризонтални редови у периодичној табели, који означавају број електронских омотача у атомима елемента, при чему елементи у истом периоду имају сличну атомску структуру.
- Групе су вертикалне колоне у периодном систему, које се састоје од елемената са истим бројем електрона у својој спољашњој љусци, што доводи до сличних хемијских својстава.
- И периоди и групе организују елементе у периодичној табели, са периодима који представљају хоризонталне редове засноване на електронским шкољкама и групама које представљају вертикалне колоне засноване на електронима спољашње љуске и хемијским својствима.
Период против Групе
Периода је хоризонтални ред који иде са леве на десну страну периодног система, а електронегативност се повећава преко њега. Група је вертикала колона која иде од врха периодног система до дна, а електронегативност расте од дна ка врху.

За време сређивања, Мендељејев је оставио неколико редова празних са утиском да ће у блиској будућности ући неки други елементи. И изненађујуће, један од елемената који се уклапао у тај јаз био је Галлиум.
Упоредна табела
| Параметар поређења | раздобље | Група |
|---|---|---|
| Лидерство | Периоди су хоризонтални редови модерног периодног система | Групе су вертикалне колоне које пролазе кроз врх периодног система |
| Некретнине | Елементи у периоду немају слична својства. | Елементи у свакој групи имају нека слична својства, али не и идентична својства. |
| Сличност | Елементи у истом периоду имају једнак број електрона састава | Елементи у свакој групи имају једнак број валентних електрона |
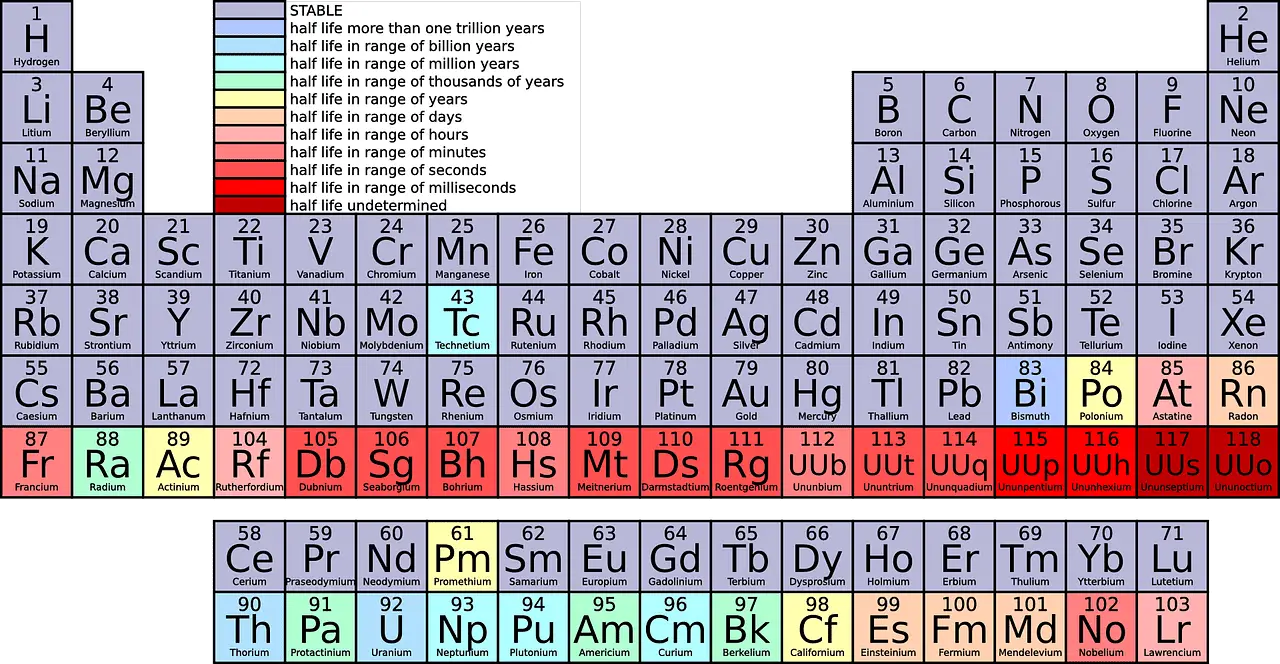
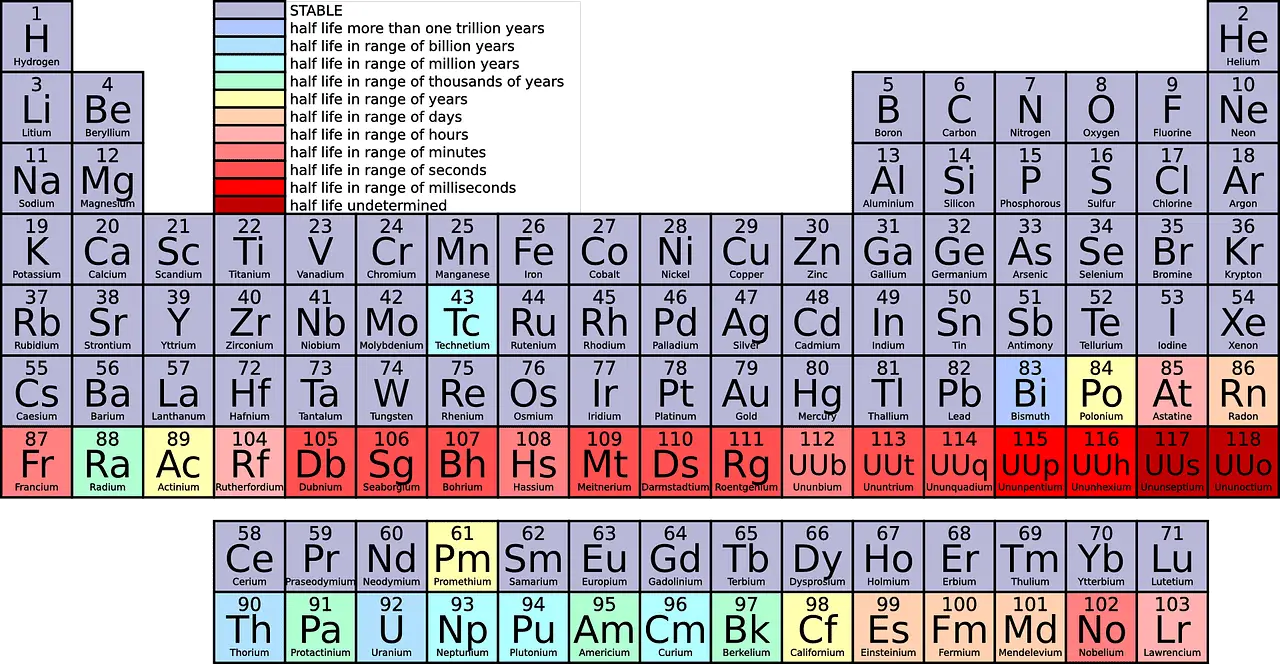
| Сума | У периодном систему има 7 периода | Група садржи 18 елемената распоређених вертикално у модерном периодном систему. |
| Електронегативност | Повећава се с лева на десно. | У групи се повећава одоздо према горе. |
Шта је Период?
Период је хоризонтални ред од крајње леве до крајње десне на периодном систему. До сада, постоји 7 периода на периодном систему.
Нови период почиње када се са електронима дода нови основни ниво енергије. Сваки елемент у периоду ће вероватно имати једнак број атомских орбитала.
На пример – сваки елемент у 1st период има само 1 орбитална за своје електроне, 2nd период укључује 2 орбитале за електроне. Слично томе, орбитале настављају да се сабирају док се крећете наниже у реду.
Величина елемента се смањује како се крећете кроз период јер број електронских шкољки остаје константан, али број протона расте у језгру. Због тога атом постаје тежи, али се величина и даље смањује.
Гледајући периодни систем, видели бисте различите елементе постављене у сваки ред. 1. период има само 2 елемента (1 и 18), 2. и 3. период имају по 8 елемената, 4. и 5. период имају 18 елемената, а 6. и 7. период имају по 32 елемента.
Шта је Група?
Рачунајући од врха до дна, у периодном систему постоји 18 група. Свим групама су додељена различита имена.
Групе су мешовите категорије метала, неметала и полуметала, груписаних у породице према сличним својствима. На пример, група 1 припада породици литијума, класификованој као алкенски метали.
Слично томе, свака група у траци има своје презиме. Елементи у сродној групи имају сличне особине јер имају исти број електрона у својим најудаљенијим омотачима.
Величина елемента се повећава како било коју групу померате надоле. То је зато што у језгру постоји велики број протона и неутрона.
Поврх овога, додатни електронски омотач чини атом тежим. За групе, постоје два различита начина да се илуструју елементи.
Разумевање оба система нумерисања је од суштинског значаја јер се периодични систем појављује у оба формата. У Сједињеним Државама су користили слова А&Б за означавање сваког елемента у групи, али је, нажалост, примећен као неорганизован систем нумерисања.
Да би се отклонила сва могућа забуна, Интернационал Унија чисте и примењене хемије (ИУПАЦ) Дошао је на идеју да нумерише елементе као (1,2, 3…18). Међутим, оба система нумерисања су прихватљива. Али ИУПАЦ-ова нумерација изгледа добро организована и директна.
Главне разлике између Период и група
- Локација: Групе су усправна колона, док су периоди равни редови у периодичној табели.
- Број: У периодном систему има укупно 18 група и 7 периода, међу којима су групе категорисане по различитим породицама и врстама метала.
- Хемијска својства: Сви елементи у групи имају аналогна хемијска или физичка својства, док периоди деле исту хијерархију електрона.
- Ниво енергије: Како идемо низ групу од врха до дна, ниво енергије електрона се повећава. С друге стране, у сваком периоду, ниво енергије електрона остаје исти.
- електронегативност: Ово опада од врха до дна у групи и расте с лева на десно у периоду. Ово је битно разматрање приликом проучавања периодног система.

Последње ажурирање: 11. јуна 2023

Пијуш Јадав је последњих 25 година провео радећи као физичар у локалној заједници. Он је физичар који страствено жели да науку учини доступнијом нашим читаоцима. Дипломирао је природне науке и постдипломске студије заштите животне средине. Више о њему можете прочитати на његовом био паге.

Одличан чланак! Ово даје сјајан увид у важност периодног система. Ја стварно уживао!
Веома ми је драго што вам је било од помоћи. Ја сам такође!
Апсолутно, сваки студент науке треба ово да прочита.
Веома информативан пост. Треба се залагати за боље образовање и разумевање научних тема.
То је управо оно што нам треба.
Ово је само још један пример застарелих образовних стандарда. Требало би да студентима предајемо релевантније теме.
Верујем да је од виталног значаја за ученике да разумеју периодни систем.
То је контроверзан став, Јоел.
Мислим да људи потцењују вредност периодног система. Требало би да учинимо више да побољшамо наше учење о томе.
Апсолутно, ово је важна тачка.
Мислим да је заиста занимљиво да тако наизглед једноставна табела може да садржи толико вредних информација.
Да, прилично је фасцинантно.
Ово је просветљујуће. Периодични систем је потцењен.
Ово је било веома потребно читање за почетак мог дана!
Неке валидне тачке су овде представљене, али још увек нисам убеђен у важност периодног система.
Слажем се са тобом, Зацх.
Периодични систем је камен темељац хемије и треба га третирати као такав.
Не бих се могао сложити више.
Не слажем се, сматрам да је учење периодног система на садашњи начин застарело и да га треба ревидирати.
Могу да видим зашто би то некима могло бити застарело, али је заиста од виталног значаја за научни развој.
Могу да видим шта говорите, али се не слажем у потпуности.
Иако разумем важност периодног система, тешко је тврдити да је тренутни образовни систем адекватан.
Покренула си важну тачку, Ерин.