Galvanické nebo elektrolytické články jsou jednou z nejdůležitějších součástí nesmírně nezbytných v polovodičovém průmyslu i mimo něj.
Galvanické články se používají v bateriích, které nám pomáhají napájet všechny velikosti spotřebičů, zatímco elektrolytické články se většinou používají pro galvanické pokovování. Mechanismus a výstup obou buněk jsou různé.
Key Takeaways
- Galvanické články generují elektrickou energii spontánními redoxními reakcemi, zatímco elektrolytické články spotřebovávají elektrickou energii k řízení nespontánních reakcí.
- V galvanických článcích je anoda místem oxidace a katoda místem redukce; v elektrolytických článcích je anoda tam, kde dochází k redukci, a katoda je místem, kde dochází k oxidaci.
- Galvanické články se běžně používají v bateriích, zatímco elektrolytické články se používají v procesech, jako je galvanizace a elektrolýza.
Galvanické články vs elektrolytické články
Galvanické články generují elektrickou energii ze spontánní redoxní reakce mezi dvěma kovovými elektrodami a vytvářejí tok elektronů pro výrobu elektrické energie. Elektrolytické články využívají elektrickou energii k řízení nespontánní redoxní reakce, produkující kovy, čištění kovů a galvanické kovy.

Galvanické články jsou také známé jako elektrochemické články, kde dochází ke spontánní reakci za účelem výroby elektřiny.
Galvanické články se skládají ze dvou poločlánků, které jsou umístěny v různých nádobách a jsou spojeny solí most nebo porézní přepážka.
Elektrolytické články lze popsat jako opak galvanických článků, protože přeměňují elektrickou energii na energii chemickou.
V celkových reakcích je Gibbsova energie kladná a v elektrolytickém článku tak probíhají nespontánní redoxní reakce.
Srovnávací tabulka
| Parametry srovnání | Galvanické články | Elektrolytické články |
|---|---|---|
| Definice | Galvanické články jsou elektrochemické články, které mohou vyrábět elektřinu. | Elektrolytické články jsou také elektrochemické články, ale k usnadnění chemických reakcí využívají elektrickou energii. |
| Konverze | Galvanické články přeměňují chemickou energii na elektrickou energii. | Elektrolytické články přeměňují elektrickou energii na chemickou energii. |
| Reakce | V galvanickém článku probíhá spontánní reakce. | V elektrolytických článcích probíhají nespontánní redoxní reakce. |
| Poplatky | Záporný náboj je na anodě, zatímco kladný náboj je na katodě. | Záporný náboj je na katodě, zatímco kladný náboj je na anodě. |
| Oxidace | Proces oxidace probíhá na anodě. | Oxidace probíhá na katodě. |
| Umístění | Poloviční články jsou umístěny v různých nádobách a jsou spojeny solným můstkem. | V roztoku elektrolytu jsou elektrody umístěny ve stejné nádobě. |
| Aplikace | Používá se v bateriích. | Většinou se používá při galvanickém pokovování a také při čištění mědi. |
Co jsou galvanické články?
V galvanickém článku je redoxní reakce, která způsobuje přenos elektronů mezi druhy, spontánní. A toto množství elektrické práce vykoná Gibbsova energie pro spontánní reakci.
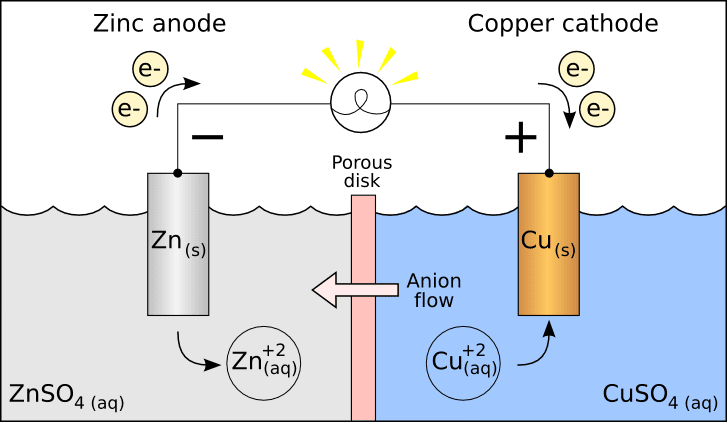
Dva půlčlánky v galvanickém článku jsou uloženy odděleně ve dvou nádobách a spojeny solným můstkem. Kovové elektrody přítomné v každém půlčlánku jsou ponořeny do elektrolytu řešení.
Pokud jsou elektrody ponořeny do stejného elektrolytu, není potřeba solný můstek.
V galvanickém článku je šest částí, jmenovitě anoda, katoda, solný můstek, poločlánky, vnější obvod a zátěž.
V tomto článku má anoda záporný potenciál a katoda kladný potenciál, obojí z hlediska řešení.
Takže, když je spínač zapnutý, kvůli rozdílu potenciálu začnou elektrony proudit z anody na katodu.
Ke studiu termodynamických vlastností tavených solí byl zaveden koncept galvanických/elektrochemických článků. Níže je uvedena reakce Danielova článku, typu galvanického článku.
Na katodě: Cu 2+ + 2e– → Cu (redukované)
Na anodě: Zn → Zn2+ + 2e– (oxidované)
Galvanické články jsou příkladem toho, jak jednoduchá reakce vyrábí energii a tuto energii lze využít k výrobě elektřiny. Tyto články se používají především v bateriích.
Co jsou elektrolytické články?
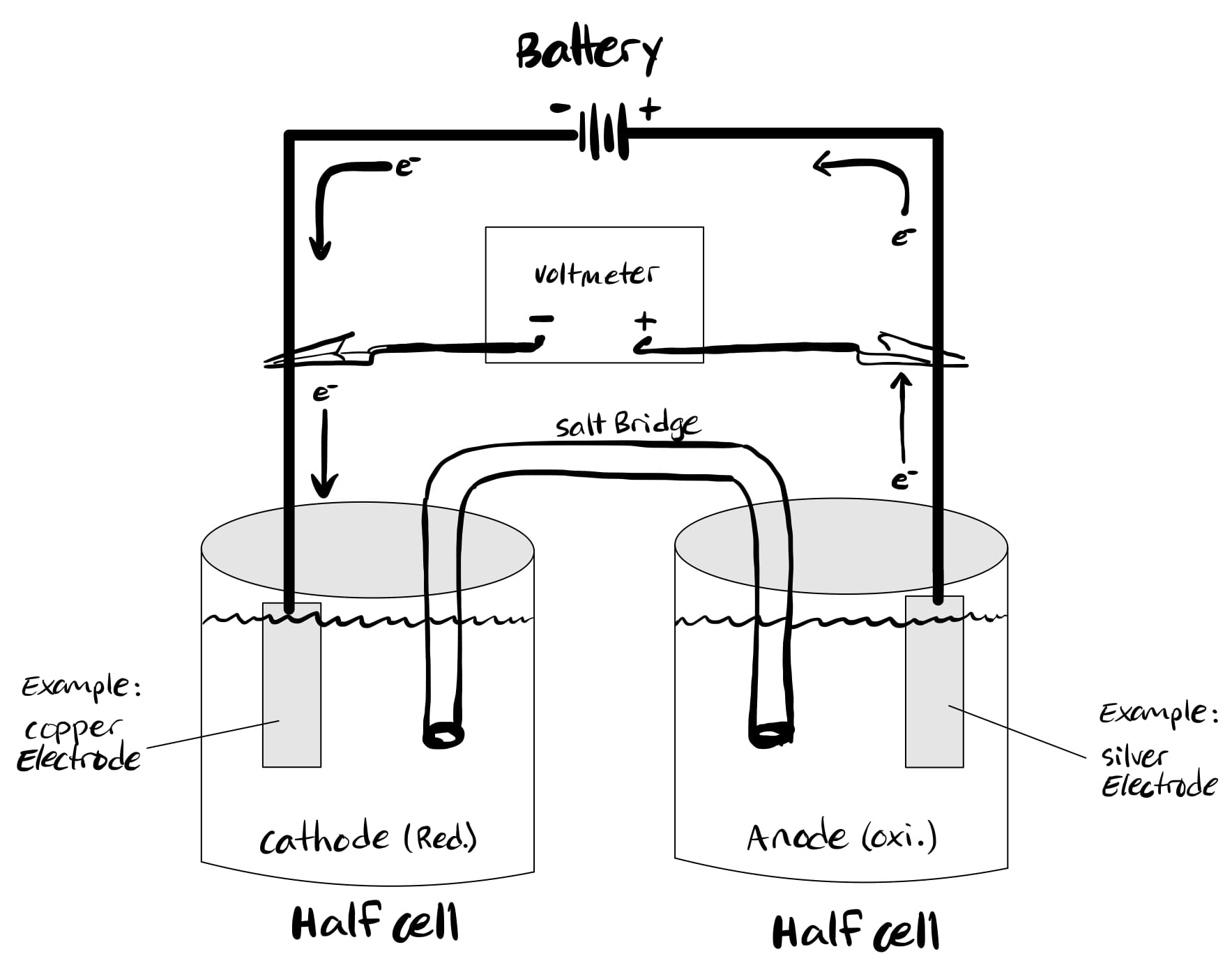
Zatímco voltaické (galvanické) články jsou poháněny spontánními chemickými reakcemi, elektrolytické články jsou poháněny nespontánními redoxními reakcemi.
Přeměňuje elektrickou energii na chemickou, což je pravý opak galvanických článků. V elektrolytickém článku, oxidace nastává na katodě, zatímco redukce probíhá na anodě.
To někdy vytváří zmatek, protože v anodě dochází k oxidaci. Je tedy snazší si zapamatovat, že v elektrolytickém článku je anoda kladná, zatímco katoda je záporná.
Celková Gibbsova energie je pozitivní, protože reakce jsou nespontánní. Elektrolytické články lze použít pro elektrolýzu určitých sloučenin, jako je voda.
Pokud je voda elektrolyzována pomocí elektrolytického článku, dojde k tvorbě plynného kyslíku a vodíku.
Mechanismus elektrolytického článku lze dobře pochopit na příkladu roztaveného chloridu sodného (NaCl). Buněčné reakce jsou uvedeny níže.
Na katodě: [Na+ + e– → Na] x 2 (sníženo)
Na anodě: 2Cl– → Cl2 + 2e– (oxidované)
Buněčná reakce: 2NaCl → 2Na + Cl2
K provedení výše uvedených reakcí jsou dvě elektrody ponořeny do roztaveného NaCl a když elektřina prochází obvodem, katoda se záporně nabije.
Sodíkové ionty (kladně nabité) jsou tedy přitahovány ke katodě a tak při redukci tvoří kovový sodík.
Hlavní rozdíly mezi galvanickými články a elektrolytickými články
- Galvanické články jsou elektrochemické články, které mohou produkovat elektřinu, zatímco elektrolytické články jsou také elektrochemické články, ale využívají elektrickou energii k usnadnění chemických reakcí.
- Galvanické články přeměňují chemickou energii na elektrickou energii, zatímco elektrolytické články přeměňují elektrickou energii na chemickou energii.
- V galvanickém článku probíhá spontánní reakce, zatímco v elektrolytických článcích probíhají nespontánní redoxní reakce.
- V galvanickém článku je záporný náboj na anodě, zatímco kladný náboj je na katodě, zatímco v elektrolytickém článku je tomu naopak.
- Proces oxidace probíhá na anodě v galvanickém článku, ale v případě elektrolytického článku probíhá na katodě.
- Poloviční články jsou umístěny v různých nádobách v galvanickém článku, zatímco v elektrolytických článcích jsou elektrody přítomny ve stejné nádobě.
- https://avesis.marmara.edu.tr/yayin/17177586-0673-4859-9b7c-66eafdae92d7/prospective-teachers-conceptual-understanding-of-electrochemistry-galvanic-and-electrolytic-cells
- https://onlinelibrary.wiley.com/doi/abs/10.1002/(SICI)1098-2736(199704)34:4%3C377::AID-TEA7%3E3.0.CO;2-O
Poslední aktualizace: 30. června 2023

Piyush Yadav strávil posledních 25 let prací jako fyzik v místní komunitě. Je to fyzik, který je zapálený pro zpřístupnění vědy našim čtenářům. Je držitelem titulu BSc v přírodních vědách a postgraduálního diplomu v oboru environmentální vědy. Více si o něm můžete přečíst na jeho bio stránka.


Skvělý článek, který velmi jasně vysvětluje rozdíly mezi galvanickými a elektrolytickými články a jejich různé aplikace. Velmi nám pomohla reakce Danielovy cely a příklad roztaveného chloridu sodného. Velmi obsáhlé a obsáhlé vysvětlení.
Tento článek poskytuje dobré srovnání mezi galvanickými a elektrolytickými články. Zdá se však, že si autor po technické stránce příliš povolil. To mohlo být jednodušší na pochopení.
Nesouhlasit. Pokud se snažíte naučit složitý předmět, jako je tento, měli byste být připraveni vypořádat se s technickými termíny a koncepty.
Cítím to stejně. Je to spousta informací ke konzumaci najednou.
Je velmi zajímavé číst, jak tyto buňky fungují a jejich různé aplikace. Skvělé příklady, snadno pochopitelné pro ty, kteří mají vědecké zázemí.
Příklady byly rozhodně nejlepší. Díky nim byly informace mnohem srozumitelnější.
To je velmi informativní, ale vysvětlení je trochu příliš technické a může být pro širokou veřejnost obtížné pochopit.
Použitá terminologie je velmi pokročilá a může vyžadovat určité nezbytné znalosti ve vědě nebo technice, abyste jí porozuměli do hloubky.
Spisovatel odvedl dobrou práci, když vysvětlil dva typy buněk. Také jsem rád, že tento text není umístěn v učebnicích.
Pro středoškoláka by to bylo nadmíru obtížné pochopit. Toto by mělo být zveřejněno pro studenty inženýrství nebo vědce.
V tomhle souhlasím s Lauren. Jedná se spíše o materiál pro pokročilé vědecké kurzy.
Toto je velmi informativní článek, přečtěte si několik článků, ale zjistil jsem, že je velmi obsáhlý, pokrývá všechny základní základy a další. Přesně to, co jsem hledal.