两种反应用吸能和放能这两个词来描述。 许多化学和生物相互作用在人体内外不断发生。
本文使用描述性表格来区分这两个反应的基本和高级区别,以方便新手和化学爱好者学习和理解。
关键精华
- 放能反应释放能量,而吸能反应从周围吸收能量。
- 放能反应具有负的吉布斯自由能变化,而吸能反应具有正的吉布斯自由能变化。
- 吸能反应是非自发的,而放能反应在给定条件下是自发的。
放能反应与吸能反应
放热的 反应是自由能变化为负的化学反应,或者存在自由能净释放并表明自发反应。 吸能反应是自由能的标准变化为正的反应,并且需要驱动力来执行该反应。

产生自由能的反应称为“放能”反应。 由于这种反应会产生能量而不是消耗能量,因此它可能会自行发生,而无需其他力量的干预。
生物化学和热化学中的放能反应是自由能变化为负(减去数值)的反应。
这些不是非自发的非自愿反应。 开始时,他们需要用力或输入力量——主要是能量形式。
吸能反应的常见作用是从碳水化合物分子或任何假定的食物分子中释放能量,让生物在不完全依赖阳光获取能量的情况下茁壮成长。
对比表
| 比较参数 | 放能反应 | 吸能反应 |
|---|---|---|
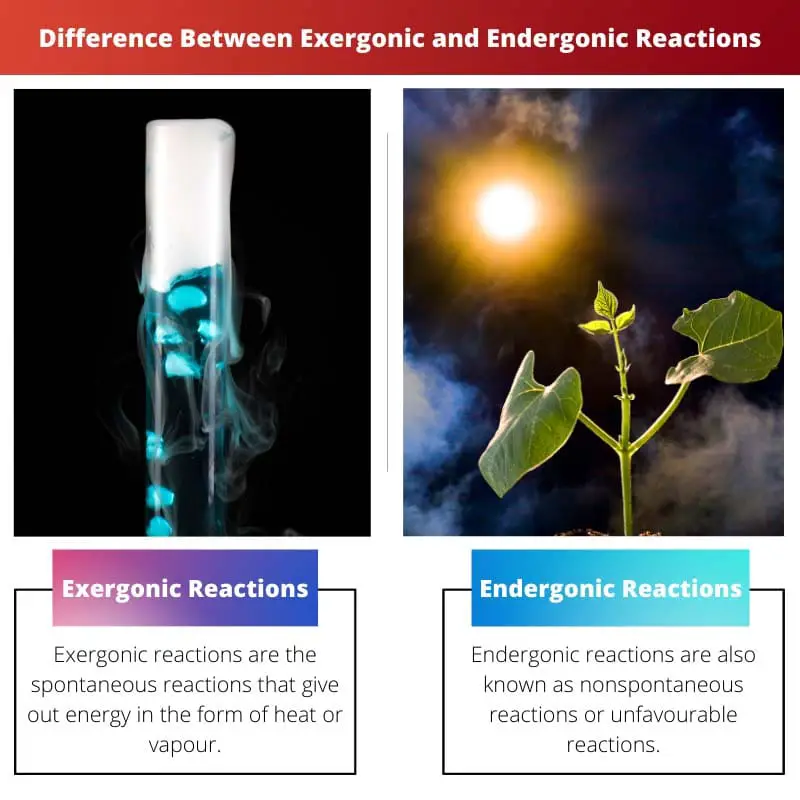
| 定义 | 放能反应是以热或蒸汽形式释放能量的自发反应。 | 吸能反应也称为非自发反应或不利反应。 反应需要比你收到更多的能量 |
| 吉布斯自由能 | 吉布斯自由能的值为负。 | 吉布斯自由能的值为正。 |
| 熵值 | 在典型的放能反应中,熵的水平会增加。 | 在吸能反应中熵减少。 |
| 能量需求 | 以热的形式释放能量。 | 通过周围环境吸收能量以引发反应或继续反应。 |
| 国际私人包机价格项目范例 | 钠和氯反应生成食盐、燃烧和化学发光。 在这个反应中,能量以光的形式释放出来。 | 光合作用的化学反应是吸能反应的一个很好的例子。 |
什么是放能反应?
Exergonic 是环境中自然发生的不可逆反应。 术语“自发”是指在很少或没有外部刺激的情况下准备好或渴望发生的事情。
例如,当遇到大气中的氧气时,钠会燃烧。 放能反应的另一个例子是木头冒烟。
在标准温度和压力下,吉布斯自由能为零,表明吸收的热量多于吸收的热量。 这些是无法逆转的反应。
生物体采用放能过程将能量从一种成分(如脂肪或糖)中的“储存”传输到激活状态,如 ATP。
什么是吸能反应?
吸收热量或任何形式的能量的过程称为吸能反应。 这意味着自由能的总体变化在化学方面是积极的。
自然界中的许多过程只有在环境中有足够的能量时才能发生。
外部能量有助于 解散 这些连接。 由于键断裂而释放的能量然后为反应提供燃料。
在吸能反应的例子中,吉布斯自由能为正 (+),表明反应不是自发的。
放能反应和吸能反应之间的主要区别
- 在放能反应中,熵增加,而在吸能反应中,熵减少。
- 放能反应的产物的能量大于反应物的能量,而在吸能反应的情况下产物的能量小于反应物的能量。
- https://www.khanacademy.org/science/biology/energy-and-enzymes/free-energy-tutorial/a/gibbs-free-energy
- https://bio.libretexts.org/Bookshelves/Introductory_and_General_Biology/Book%3A_General_Biology_(Boundless)/6%3A_Metabolism/6.2%3A_Potential_Kinetic_Free_and_Activation_Energy/6.2A%3A__Free_Energy
最后更新:07 年 2023 月 XNUMX 日

Piyush Yadav 在过去的 25 年里一直在当地社区担任物理学家。 他是一位物理学家,热衷于让我们的读者更容易理解科学。 他拥有自然科学学士学位和环境科学研究生文凭。 你可以在他的网站上阅读更多关于他的信息 生物页面.


本文对放能和吸能反应进行了全面分析,阐明了它们在化学和生物相互作用中的重要性。
本文对放能和吸能反应进行了深入而全面的解释。比较表和示例对于理解主要差异特别有帮助。
这篇文章内容丰富且结构良好。放能反应和吸能反应之间的明确区别使读者更容易掌握这些概念。
这篇文章对放能和吸能反应的阐述值得称赞,为读者提供了对其所控制的化学和生物过程的熟练理解。
这篇文章巧妙地解释了放能反应和吸能反应之间的二分法,举例说明了它们在各种自然现象中的含义。
这篇文章对放能和吸能反应的解释非常清晰且富有教育意义。提供的现实生活中的例子作为实际说明,有助于更好地理解这个概念。
放能反应和吸能反应之间的全面比较值得称赞,精确而清晰地阐明了核心差异。
详细的比较表有效地突出了放能反应和吸能反应之间的根本差异,以满足不同专业水平的读者的需求。使用描述性示例进一步增强理解。