تعد الخلايا الجلفانية أو الإلكتروليتية من أهم المكونات الضرورية للغاية في صناعة أشباه الموصلات وخارجها.
تُستخدم الخلايا الجلفانية في البطاريات لتساعدنا على تشغيل كل حجم من الأجهزة بينما تستخدم الخلايا الإلكتروليتية في الغالب للطلاء الكهربائي. تختلف آلية ومخرجات كلا الخليتين.
الوجبات السريعة الرئيسية
- تولد الخلايا الجلفانية طاقة كهربائية من خلال تفاعلات الأكسدة والاختزال العفوية ، بينما تستهلك الخلايا الإلكتروليتية الطاقة الكهربائية لدفع التفاعلات غير التلقائية.
- في الخلايا الجلفانية ، الأنود هو موقع الأكسدة ، والكاثود هو موقع الاختزال ؛ في الخلايا الإلكتروليتية ، القطب الموجب هو المكان الذي يحدث فيه الاختزال ، والكاثود هو المكان الذي تحدث فيه الأكسدة.
- تستخدم الخلايا الجلفانية بشكل شائع في البطاريات ، بينما تستخدم الخلايا الإلكتروليتية في عمليات مثل الطلاء الكهربائي والتحليل الكهربائي.
الخلايا الجلفانية مقابل الخلايا الالكتروليتية
تولد الخلايا الجلفانية طاقة كهربائية من تفاعل الأكسدة والاختزال التلقائي بين قطبين معدنيين ، مما يؤدي إلى تدفق الإلكترونات لإنتاج الطاقة الكهربائية. تستخدم الخلايا الإلكتروليتية الطاقة الكهربائية لتحريك تفاعل الأكسدة والاختزال غير التلقائي ، وإنتاج المعادن ، وتنقية المعادن ، ومعادن الطلاء بالكهرباء.

تُعرف الخلايا الجلفانية أيضًا بالخلايا الكهروكيميائية حيث يحدث تفاعل عفوي لإنتاج الكهرباء.
تتكون الخلايا الجلفانية من خليتين نصفيتين موضوعتين في حاويات مختلفة ومتصلين بواسطة ملح جسر أو قسم مسامي.
يمكن وصف الخلايا الإلكتروليتية بأنها عكس الخلايا الجلفانية لأنها تحول الطاقة الكهربائية إلى طاقة كيميائية.
في التفاعلات الكلية ، تكون طاقة جيبس إيجابية ، وبالتالي تحدث تفاعلات الأكسدة والاختزال غير العفوية في خلية إلكتروليتية.
جدول المقارنة
| معلمات المقارنة | الخلايا الجلفانية | خلايا التحليل الكهربائي |
|---|---|---|
| تعريف | الخلايا الجلفانية هي خلايا كهروكيميائية يمكنها إنتاج الكهرباء. | الخلايا الالكتروليتية هي أيضًا خلايا كهروكيميائية ولكنها تستخدم الطاقة الكهربائية لتسهيل التفاعلات الكيميائية. |
| تحويل | تقوم الخلايا الجلفانية بتحويل الطاقة الكيميائية إلى طاقة كهربائية. | تقوم الخلايا الإلكتروليتية بتحويل الطاقة الكهربائية إلى طاقة كيميائية. |
| رد فعل | في الخلية الجلفانية ، يحدث تفاعل عفوي. | تحدث تفاعلات الأكسدة والاختزال غير العفوية في الخلايا الإلكتروليتية. |
| الرسوم | الشحنة السالبة عند القطب الموجب بينما الشحنة الموجبة عند الكاثود. | الشحنة السالبة عند القطب السالب بينما الشحنة الموجبة عند القطب الموجب. |
| أكسدة | تتم عملية الأكسدة عند الأنود. | تحدث الأكسدة عند الكاثود. |
| تحديد المستوى | توضع الخلايا النصفية في حاويات مختلفة ويتم توصيلها عبر جسر ملح. | في محلول الإلكتروليت ، توضع الأقطاب الكهربائية في نفس الحاوية. |
| التطبيقات | تستخدم في البطاريات. | تستخدم في الغالب في الطلاء الكهربائي وكذلك في تنقية النحاس. |
ما هي الخلايا الجلفانية؟
في الخلية الجلفانية ، يكون تفاعل الأكسدة والاختزال الذي يسبب انتقال الإلكترونات بين الأنواع تلقائيًا. وهذا المقدار من الشغل الكهربائي يتم بواسطة طاقة جيبس للتفاعل التلقائي.
يتم الاحتفاظ بالخلايا النصفية في خلية كلفانية بشكل منفصل في حاويتين ومتصلة بجسر ملح. يتم غمس الأقطاب المعدنية الموجودة في كل نصف خلية في إلكتروليت حل.
إذا تم غمس الأقطاب الكهربائية في نفس المنحل بالكهرباء ، فلا حاجة لجسر الملح.
توجد ستة أجزاء في الخلية الجلفانية ، وهي الأنود ، والكاثود ، والجسر الملح ، ونصف الخلايا ، والدائرة الخارجية ، والحمل.
في هذه الخلية ، يكون للأنود إمكانات سلبية والكاثود له إمكانات إيجابية ، سواء فيما يتعلق بالحل.
لذلك ، عند ضبط المفتاح ، نظرًا لاختلاف الجهد ، تبدأ الإلكترونات التي تم إنشاؤها في التدفق من القطب الموجب إلى القطب السالب.
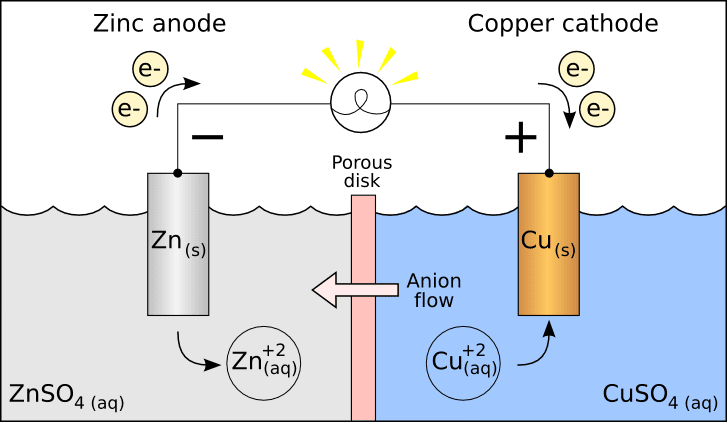
تم تقديم مفهوم الخلايا الجلفانية / الكهروكيميائية لدراسة الخصائص الديناميكية الحرارية للأملاح المنصهرة. فيما يلي رد فعل خلية دانيال ، وهي نوع من الخلايا الجلفانية.
عند الكاثود: Cu 2+ + 2e– → Cu (مخفض)
عند الأنود: Zn → Zn2 + + 2e– (مؤكسد)
الخلايا الجلفانية هي مثال على كيفية إنتاج تفاعل بسيط للطاقة ويمكن استخدام تلك الطاقة لإنتاج الكهرباء. تستخدم هذه الخلايا بشكل رئيسي في البطاريات.
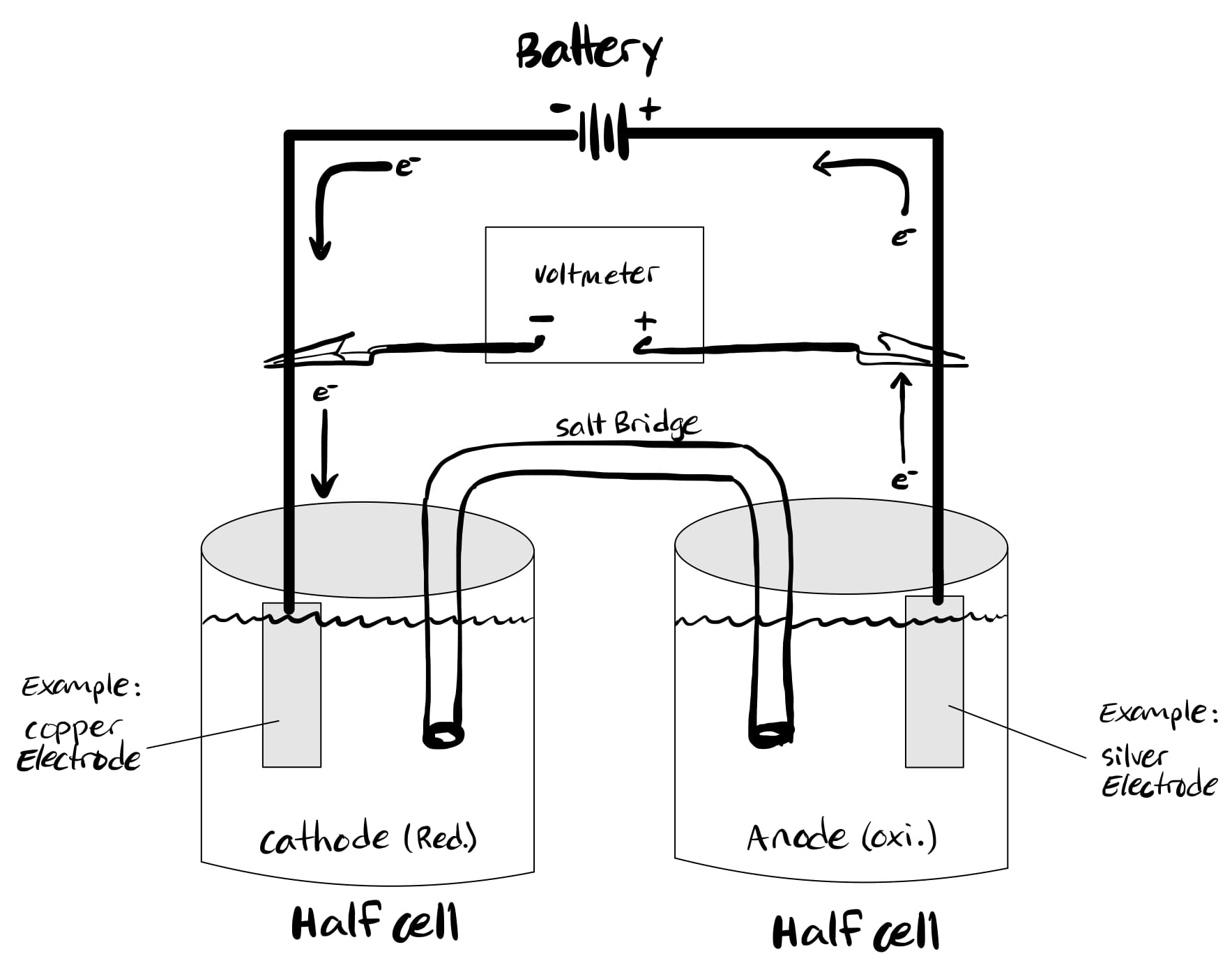
ما هي الخلايا الالكتروليتية؟
في حين أن الخلايا الفولتية (الجلفانية) مدفوعة بتفاعلات كيميائية عفوية ، فإن الخلايا الإلكتروليتية مدفوعة بتفاعلات الأكسدة والاختزال غير العفوية.
إنه يحول الطاقة الكهربائية إلى طاقة كيميائية ، عكس الخلايا الجلفانية تمامًا. في خلية التحليل الكهربائي ، أكسدة يحدث عند الكاثود بينما يحدث الاختزال عند الأنود.
يؤدي هذا أحيانًا إلى حدوث ارتباك لأن الأكسدة تحدث في الأنود. لذلك ، من الأسهل تذكر أن القطب الموجب في خلية التحليل الكهربائي يكون موجبًا بينما الكاثود سالب.
طاقة جيبس الكلية إيجابية لأن التفاعلات غير عفوية. يمكن استخدام الخلايا الإلكتروليتية في التحليل الكهربائي لبعض المركبات ، مثل الماء.
إذا تم تحليل الماء بالكهرباء باستخدام خلية إلكتروليتية ، فسيحدث تكوين الأكسجين الغازي والهيدروجين.
يمكن فهم آلية الخلية الإلكتروليتية جيدًا باستخدام مثال كلوريد الصوديوم المنصهر (كلوريد الصوديوم). ردود الفعل الخلية معطاة أدناه.
عند الكاثود: [Na + e– → Na] × 2 (مخفض)
عند الأنود: 2Cl– → Cl2 + 2e– (مؤكسد)
تفاعل الخلية: 2NaCl → 2Na + Cl2
لتنفيذ التفاعلات المذكورة أعلاه ، يتم غمس قطبين كهربائيين في كلوريد الصوديوم المنصهر وعندما يتم تمرير الكهرباء عبر الدائرة ، يصبح القطب السالب مشحونًا.
لذلك ، تنجذب أيونات الصوديوم (موجبة الشحنة) نحو الكاثود وبالتالي تشكل الصوديوم المعدني عند الاختزال.
الاختلافات الرئيسية بين الخلايا الجلفانية وخلايا التحليل الكهربائي
- الخلايا الجلفانية هي خلايا كهروكيميائية يمكنها إنتاج الكهرباء بينما الخلايا الكهروكيميائية هي أيضًا خلايا كهروكيميائية ولكنها تستخدم الطاقة الكهربائية لتسهيل التفاعلات الكيميائية.
- تقوم الخلايا الجلفانية بتحويل الطاقة الكيميائية إلى طاقة كهربائية بينما تقوم الخلايا الإلكتروليتية بتحويل الطاقة الكهربائية إلى طاقة كيميائية.
- في الخلية الجلفانية ، يحدث تفاعل عفوي بينما تحدث تفاعلات الأكسدة والاختزال غير العفوية في الخلايا الإلكتروليتية.
- في الخلية الجلفانية ، تكون الشحنة السالبة عند القطب الموجب بينما الشحنة الموجبة عند القطب السالب بينما في الخلية الإلكتروليتية تكون عكس ذلك.
- تحدث عملية الأكسدة عند القطب الموجب في الخلية الجلفانية ولكن في حالة الخلية الإلكتروليتية ، تحدث في القطب السالب.
- توضع الخلايا النصفية في حاويات مختلفة في خلية كلفانية بينما في الخلايا الإلكتروليتية ، توجد الأقطاب الكهربائية في نفس الحاوية.
- https://avesis.marmara.edu.tr/yayin/17177586-0673-4859-9b7c-66eafdae92d7/prospective-teachers-conceptual-understanding-of-electrochemistry-galvanic-and-electrolytic-cells
- https://onlinelibrary.wiley.com/doi/abs/10.1002/(SICI)1098-2736(199704)34:4%3C377::AID-TEA7%3E3.0.CO;2-O
آخر تحديث: 30 يونيو 2023

أمضى بيوش ياداف السنوات الخمس والعشرين الماضية في العمل كفيزيائي في المجتمع المحلي. إنه فيزيائي شغوف بجعل العلم في متناول قرائنا. وهو حاصل على بكالوريوس في العلوم الطبيعية ودبلوم دراسات عليا في علوم البيئة. يمكنك قراءة المزيد عنه على موقعه صفحة بيو.


مقالة رائعة تشرح بوضوح شديد الاختلافات بين الخلايا الجلفانية والخلايا التحليلية وتطبيقاتها المختلفة. كان رد فعل خلية دانيال ومثال كلوريد الصوديوم المنصهر مفيدًا جدًا. شرح دقيق وشامل للغاية.
توفر هذه المقالة مقارنة جيدة بين الخلايا الجلفانية والخلايا التحليلية. ومع ذلك، يبدو أن المؤلف قد اتخذ الكثير من الحرية من الناحية الفنية. كان من الممكن أن يكون هذا أسهل للفهم.
تعارض. إذا كنت تحاول تعلم موضوع معقد مثل هذا، فيجب أن تكون مستعدًا للتعامل مع المصطلحات والمفاهيم الفنية.
أشعر بنفس الطريقة. إنها معلومات كثيرة يجب استهلاكها في وقت واحد.
ومن المثير للاهتمام أن نقرأ كيفية عمل هذه الخلايا وتطبيقاتها المختلفة. أمثلة رائعة وسهلة الفهم لمن لديهم خلفية علمية.
وكانت الأمثلة بالتأكيد الجزء الأفضل. لقد جعلوا المعلومات أسهل بكثير في الفهم.
هذا مفيد للغاية، ولكن الشرح تقني للغاية وقد يكون من الصعب فهمه لعامة الناس.
المصطلحات المستخدمة متقدمة جدًا وقد تحتاج إلى بعض المعرفة الأساسية في العلوم أو الهندسة لفهمها بعمق.
لقد قام الكاتب بعمل جيد في شرح نوعي الخلايا. كما يسعدني أن هذا النص غير موجود في الكتب المدرسية.
سيكون هذا أمرًا صعب الفهم بالنسبة لطالب المدرسة الثانوية. وينبغي نشر هذا لطلاب الهندسة أو العلماء.
وأنا أتفق مع لورين في هذا. هذا هو أكثر من مادة دورة العلوم ذات المستوى المتقدم.
هذه مقالة غنية بالمعلومات، قرأت العديد من المقالات ولكنني وجدتها شاملة للغاية، وتغطي جميع الأساسيات الأساسية والمزيد. بالضبط ما كنت أبحث عنه.