Dva druhy reakcí jsou popsány slovy endergonická a exergonická. V lidském těle i mimo něj neustále dochází k mnoha chemickým a biologickým interakcím.
Tento článek používá popisnou tabulku k rozlišení základních a pokročilých rozdílů mezi těmito dvěma reakcemi pro snadné učení a pochopení pro nováčka i pro chemického nadšence.
Key Takeaways
- Exergonické reakce uvolňují energii, zatímco endergonické reakce absorbují energii ze svého okolí.
- Exergonické reakce mají negativní Gibbsovu změnu volné energie, zatímco endergonické reakce mají pozitivní.
- Endergonické reakce jsou nespontánní, zatímco exergonické reakce jsou za daných podmínek spontánní.
Exergonické reakce vs. Endergonické reakce
Exergonický reakce jsou chemické reakce, ve kterých je změna volné energie negativní, nebo dochází k čistému uvolnění volné energie a ukazuje na spontánní reakci. Endergonické reakce jsou reakce, ve kterých je standardní změna volné energie pozitivní a k jejímu provedení je zapotřebí hnací síla.

Reakce, která generuje volnou energii, je známá jako „exergonická“ reakce. Protože tato reakce energii spíše produkuje než spotřebovává, může k ní dojít sama o sobě, bez zásahu jiných sil.
Exergonické reakce v biochemii, stejně jako v termochemii, jsou takové, u kterých je změna volné energie negativní (mínus v číselné hodnotě).
Nejedná se o nedobrovolné reakce, které jsou nespontánní. Aby mohli začít, potřebují námahu nebo přísun síly – především ve formě energie.
Běžnou úlohou endergonické reakce je uvolnit energii z molekul sacharidů nebo jakékoli předpokládané molekuly potravy, což umožňuje tvorům prosperovat, aniž by se jako energie spoléhaly pouze na sluneční světlo.
Srovnávací tabulka
| Parametry srovnání | Exergonické reakce | Endergonické reakce |
|---|---|---|
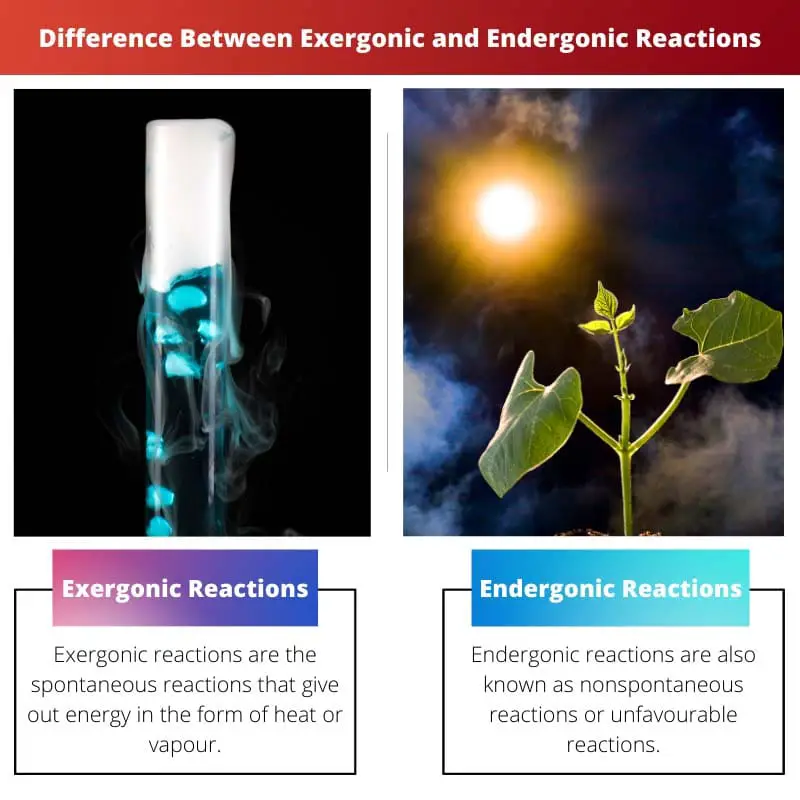
| Definice | Exergonické reakce jsou spontánní reakce, které uvolňují energii ve formě tepla nebo páry. | Endergonické reakce jsou také známé jako nespontánní reakce nebo nepříznivé reakce. Reakce vyžaduje více energie, než přijímáte |
| Gibbs Free Energy | Hodnota Gibbs Free Energy je záporná. | Hodnota Gibbs Free Energy je pozitivní. |
| Úroveň entropie | Úroveň entropie se zvyšuje při typické exergonické reakci. | Entropie je snížena v endergonické reakci. |
| Energetický požadavek | Vydává energii ve formě tepla. | Přijímá energii okolím pro zahájení reakce nebo její pokračování. |
| Příklady | Reakce sodíku a chlóru za vzniku kuchyňské soli, spalování a chemiluminiscence. Při této reakci se energie uvolňuje ve formě světla. | Chemická reakce fotosyntézy je dobrým příkladem endergonických reakcí. |
Co jsou exergonické reakce?
Exergonické jsou nevratné reakce, které se přirozeně vyskytují v prostředí. Termín „spontánní“ se vztahuje k něčemu, co je připraveno nebo dychtivě nastat s malou nebo žádnou vnější stimulací.
Při vystavení kyslíku v atmosféře bude hořet například sodík. Dalším příkladem exergonických reakcí je uzení dřeva.
Při standardní teplotě a tlaku je Gibbsova volná energie nulová, což naznačuje, že je více tepla odebíráno, než absorbováno. To jsou reakce, které nelze vrátit zpět.
Živé organismy využívají exergonické procesy k transportu energie ze „skladování“ v jedné složce, jako je tuk nebo cukr, do aktivovaného stavu, jako je ATP.
Co jsou Endergonické reakce?
Proces, ve kterém je absorbováno teplo nebo jakákoli forma energie, je známý jako endergonická reakce. To znamená, že celková změna volné energie je z chemického hlediska pozitivní.
Mnoho procesů v přírodě může probíhat pouze tehdy, je-li k dispozici dostatečná energie z prostředí.
Vnější energie pomáhá v rozpuštění těchto spojení. Energie uvolněná v důsledku přerušení vazby pak podporuje reakci.
V případě endergonických reakcí je tato Gibbsova volná energie kladná (+), což ukazuje, že reakce není spontánní.
Hlavní rozdíly mezi exergonickými a endergonickými reakcemi
- U exergonických reakcí se entropie zvyšuje, zatímco u endergonických reakcí entropie klesá.
- Energie produktů exergonické reakce je větší než energie reaktantů, zatímco energie produktů je v případě endergonických reakcí menší než energie reaktantů.
- https://www.khanacademy.org/science/biology/energy-and-enzymes/free-energy-tutorial/a/gibbs-free-energy
- https://bio.libretexts.org/Bookshelves/Introductory_and_General_Biology/Book%3A_General_Biology_(Boundless)/6%3A_Metabolism/6.2%3A_Potential_Kinetic_Free_and_Activation_Energy/6.2A%3A__Free_Energy
Poslední aktualizace: 07. září 2023

Piyush Yadav strávil posledních 25 let prací jako fyzik v místní komunitě. Je to fyzik, který je zapálený pro zpřístupnění vědy našim čtenářům. Je držitelem titulu BSc v přírodních vědách a postgraduálního diplomu v oboru environmentální vědy. Více si o něm můžete přečíst na jeho bio stránka.


Tento článek představuje důkladnou analýzu exergonických a endergonických reakcí a osvětluje jejich význam v chemických a biologických interakcích.
Tento článek poskytuje zasvěcené a komplexní vysvětlení exergonických a endergonických reakcí. Srovnávací tabulka a příklady jsou zvláště užitečné pro pochopení klíčových rozdílů.
Článek je velmi informativní a dobře strukturovaný. Jasné rozlišení mezi exergonickými a endergonickými reakcemi usnadňuje čtenářům pochopení pojmů.
Objasnění exergonických a endergonických reakcí v článku je chvályhodné a nabízí čtenářům zdatné pochopení chemických a biologických procesů, které řídí.
Článek šikovně vysvětluje dichotomii mezi exergonickými a endergonickými reakcemi a ukazuje jejich důsledky v různých přírodních jevech.
Vysvětlení exergonických a endergonických reakcí v článku je velmi výmluvné a poučné. Uvedené příklady ze života slouží jako praktické ilustrace a přispívají k lepšímu pochopení konceptu.
Komplexní srovnání mezi exergonickými a endergonickými reakcemi je chvályhodné a objasňuje základní rozdíly s přesností a jasností.
Podrobná srovnávací tabulka účinně zdůrazňuje zásadní rozdíly mezi exergonickými a endergonickými reakcemi a vyhovuje čtenářům s různou úrovní odbornosti. Použití popisných příkladů dále zlepšuje porozumění.