I kemi dannes forskellige forbindelser af forskellige typer bindinger mellem molekylerne.
Forskellige faktorer bestemmer, hvilken type binding der skal dannes mellem forskellige molekyler, og typen af molekyler spiller en stor rolle i dannelsen af sådanne bindinger.
En binding er en tiltrækningskraft, der virker mellem to molekyler.
Nøgleforsøg
- Ionbindinger dannes mellem metaller og ikke-metaller gennem overførsel af elektroner, mens kovalente bindinger dannes mellem ikke-metaller gennem elektrondeling.
- Ioniske forbindelser har høje smelte- og kogepunkter, mens kovalente forbindelser har lavere smelte- og kogepunkter.
- Ioniske forbindelser leder elektricitet, når de opløses i vand eller smeltes, men det gør kovalente forbindelser ikke.
Ioniske bindinger vs kovalente bindinger
Ionbindinger dannes mellem atomer gennem overførsel af elektroner, hvilket skaber ioner, der tiltrækkes af hinanden på grund af deres modsatte ladninger. Kovalente bindinger involverer deling af elektroner mellem atomer, hvilket skaber en gensidig tiltrækning, der holder atomerne sammen.
En ionbinding dannes i tilfælde af ioniske forbindelser. Ioniske forbindelser er lavet af molekyler, der indeholder ladede ioner, som enten kan være positivt eller negativt ladede.
Dette skaber således en tiltrækningskraft mellem molekylerne, da modsatte ladninger tiltrækker hinanden. Denne tiltrækningskraft resulterer i dannelsen af bindingen.
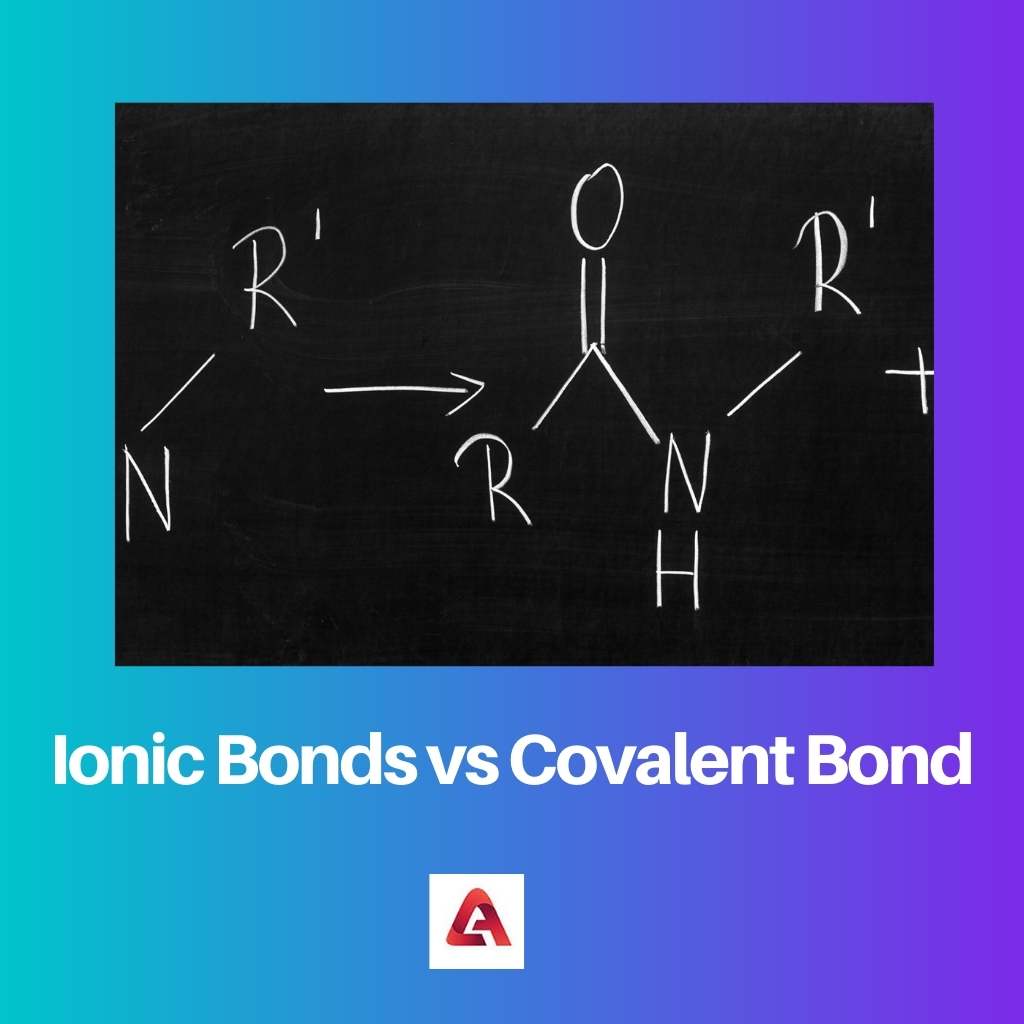
Kovalente bindinger dannes mellem ikke-metaller. Denne type binding dannes på grund af deling af elektroner mellem to molekyler.
Da et af molekylerne i en kovalent forbindelse er elektronmangel, modtager den det nødvendige antal elektroner fra donormolekylerne for at skabe en stabil kovalent forbindelse.
Sammenligningstabel
| Parametre for sammenligning | Ionisk binding | Kovalent binding |
|---|---|---|
| Creation | Ionbindinger dannes på grund af overførsel af ioner mellem molekyler | Kovalente bindinger dannes på grund af deling af elektroner mellem to molekyler |
| Sammensætningens tilstand | De dannede forbindelser er kun til stede i fast form | De dannede forbindelser er til stede i alle stoftilstande |
| Type af molekyler | Bindingen sker mellem et metal og et ikke-metal | Bindingen sker mellem to ikke-metaller |
| Polaritet | Ioniske forbindelser er upolære | Kovalente forbindelser er polære |
| Smeltepunkt | Ioniske forbindelser har højere smeltepunkter | Kovalente forbindelser har lavere smeltepunkter |
Hvad er Ionic Bond?
En ionbinding er en af de tre typer bindinger, der opstår mellem molekyler og danner en ionforbindelse.
Bindingen sker mellem et metal og et ikke-metal, og et af de mest almindelige eksempler på en sådan forbindelse er salt (NaCl), hvori natrium (Na) er et metal, og klor (Cl) er et ikke-metal.
Det er en stærk binding og kan ikke brydes så let som i tilfælde af kovalente bindinger. Bindingen opstår på grund af en deling af elektroner mellem metallet og ikke-metallet.
Et af molekylerne i en ionforbindelse er elektronmangel, mens det andet molekyle er elektronrigt, hvilket skaber en tiltrækningskraft mellem de to molekyler.
Den elektrostatiske tiltrækningskraft resulterer i interaktionen mellem de to molekyler, der deler elektroner fra det elektronrige atom til det elektronmangelfulde atom.
Donoratomet eller -molekylet overfører fuldstændigt atomet til modtagermolekylet eller -atomet, hvilket resulterer i en stærk og ren binding mellem de to molekyler.
Sådanne ioniske forbindelsers egenskaber er deres høje smeltepunkter og høje elektriske ledningsevne i smeltet eller opløst tilstand. Ioniske forbindelser er også meget opløselige i vand.

Hvad er kovalent binding?
En kovalent binding er en type kemisk binding mellem molekyler, der fører til dannelsen af en kovalent forbindelse.
Det er den svageste af de tre typer kemiske bindinger, og molekylerne i en kovalent forbindelse kan let adskilles.
Kovalente bindinger dannes mellem to ikke-metaller, og bindingen af metaller af molekyler afhænger af antallet af elektroner valensskal.
Binding sker ved deling af elektronpar, og denne deling af elektroner sker for at opretholde den kemiske balance mellem molekylerne eller atomerne.
Delingen af elektroner mellem to ustabile molekyler skaber en stabil valensskal i begge molekyler.
Når begge atomer har nået deres fulde valenstilstand, dannes der en binding mellem de to atomer eller molekyler.
Det delte elektronpar er til stede mellem begge atomer for at opretholde stabiliteten af forbindelsen.
Det mest almindelige eksempel på en kovalent binding er mellem de to hydrogenatomer i et H2-molekyle.
I et H2-molekyle deler de to hydrogenatomer to elektroner, hvilket fører til en kovalent binding.
Nøglefaktoren, der kræves for dannelsen af en kovalent binding, er molekylernes elektronegativitet. To atomer med lignende elektronegativitet resulterer i en kovalent binding.

Vigtigste forskelle mellem ionisk og kovalent binding
- Ionbindinger dannes på grund af overførsel af ioner mellem molekyler. Kovalente bindinger dannes på grund af deling af elektroner mellem atomer.
- Ioniske forbindelser er kun til stede i fast tilstand. Kovalente forbindelser er til stede i alle materiens tilstande.
- En ionbinding dannes mellem et metal og et ikke-metal. En kovalent binding dannes mellem to ikke-metaller.
- Ioniske forbindelser er ikke-polære, hvorimod kovalente forbindelser er polære
- Ioniske forbindelser har meget høje smeltepunkter, hvorimod kovalente forbindelser har lave smeltepunkter.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Sidst opdateret: 14. juni 2023

Piyush Yadav har brugt de sidste 25 år på at arbejde som fysiker i lokalsamfundet. Han er en fysiker, der brænder for at gøre videnskaben mere tilgængelig for vores læsere. Han har en bachelorgrad i naturvidenskab og en postgraduate diplomuddannelse i miljøvidenskab. Du kan læse mere om ham på hans bio side.


Fascinerende information om ioniske og kovalente bindinger, mængden af information beskrevet i artiklen er bemærkelsesværdig og meget let at forstå
Interessant artikel. Jeg værdsætter den dybtgående diskussion om egenskaberne ved ioniske og kovalente forbindelser.
Jeg er uenig. Kovalente bindinger er ikke nødvendigvis de svageste af de tre typer kemiske bindinger. Der er tilfælde, hvor de er stærkere end ionbindinger.
Det er sandt under visse omstændigheder, men generelt holder udtalelsen. Kovalente bindinger anses for at være de svageste på grund af, at det er nemt at bryde bindingen.
Fremragende forklaring på ioniske og kovalente bindinger. Jeg ser frem til at læse mere fra denne forfatter.
Ja, indlægget var meget informativt og let at forstå. Jeg sætter pris på sammenligningstabellen for at opsummere forskellene mellem de to typer obligationer.
Denne artikel forenkler emnet, men der ser ud til at være en alvorlig mangel på datahenvisning. Mere troværdighed kan gives med korrekte citater
Jeg er enig. Jeg tjekkede referencerne, og de er troværdige kilder.
Jeg fandt oplysningerne meget nyttige, især til min kommende kemi-eksamen
Forfatteren ser ud til at være meget vidende, når det kommer til kemi. Jeg nyder at læse detaljerede indlæg som denne.
Aftalt. Sammenligningstabellen er meget nyttig til at fremhæve forskellene mellem ioniske og kovalente bindinger.
Artiklen forklarer de emner, som er meget nyttige til introduktionslæring.
Dette indlæg giver et omfattende overblik over ioniske og kovalente bindinger. Eksemplerne er meget nyttige til at forstå begreberne.
Tilstrækkelig information, der er værdifuld til uddannelsesformål. Et must-read for gymnasieelever
Sammenligningstabellen er en fantastisk måde at illustrere forskellene på, for alle med en grundlæggende viden om kemi kunne denne artikel være en vidunderlig ressource
Jeg er enig. De vigtigste takeaways er også ret nyttige og forenkler koncepterne.
Artiklen præsenterer tydeligt forskellene mellem ioniske og kovalente bindinger. Jeg fandt det meget nyttigt.