Deux types de réactions sont décrites par les mots endergonic et exergonic. De nombreuses interactions chimiques et biologiques se produisent continuellement à l'intérieur et à l'extérieur du corps humain.
Cet article utilise un tableau descriptif pour distinguer les distinctions fondamentales et avancées entre les deux réactions pour faciliter l'apprentissage et la compréhension par un novice ainsi que par un passionné de chimie.
Faits marquants
- Les réactions exergoniques libèrent de l'énergie, tandis que les réactions endergoniques absorbent l'énergie de leur environnement.
- Les réactions exergoniques ont un changement d'énergie libre de Gibbs négatif, tandis que les réactions endergoniques ont un changement positif.
- Les réactions endergoniques ne sont pas spontanées, alors que les réactions exergoniques sont spontanées dans des conditions données.
Réactions exergoniques vs réactions endergoniques
exergonique les réactions sont des réactions chimiques dans lesquelles le changement d'énergie libre est négatif, ou il y a une libération nette d'énergie libre et indique une réaction spontanée. Les réactions endergoniques sont des réactions dans lesquelles le changement standard de l'énergie libre est positif et une force motrice est nécessaire pour y parvenir.

Une réaction qui génère de l'énergie libre est connue sous le nom de réaction «exergonique». Comme cette réaction produit de l'énergie au lieu d'en consommer, elle peut se produire d'elle-même, sans l'intervention d'autres forces.
Les réactions exergoniques en biochimie, ainsi qu'en thermochimie, sont celles dans lesquelles la variation de l'énergie libre est négative (moins en valeur numérique).
Ce ne sont pas des réactions involontaires qui ne sont pas spontanées. Pour commencer, ils ont besoin d'efforts ou d'un apport de force - principalement sous forme d'énergie.
Le rôle commun d'une réaction endergonique est de libérer l'énergie des molécules de glucides ou de toute molécule alimentaire supposée, permettant aux créatures de prospérer sans compter uniquement sur la lumière du soleil pour l'énergie.
Tableau de comparaison
| Paramètres de comparaison | Réactions exergoniques | Réactions endergoniques |
|---|---|---|
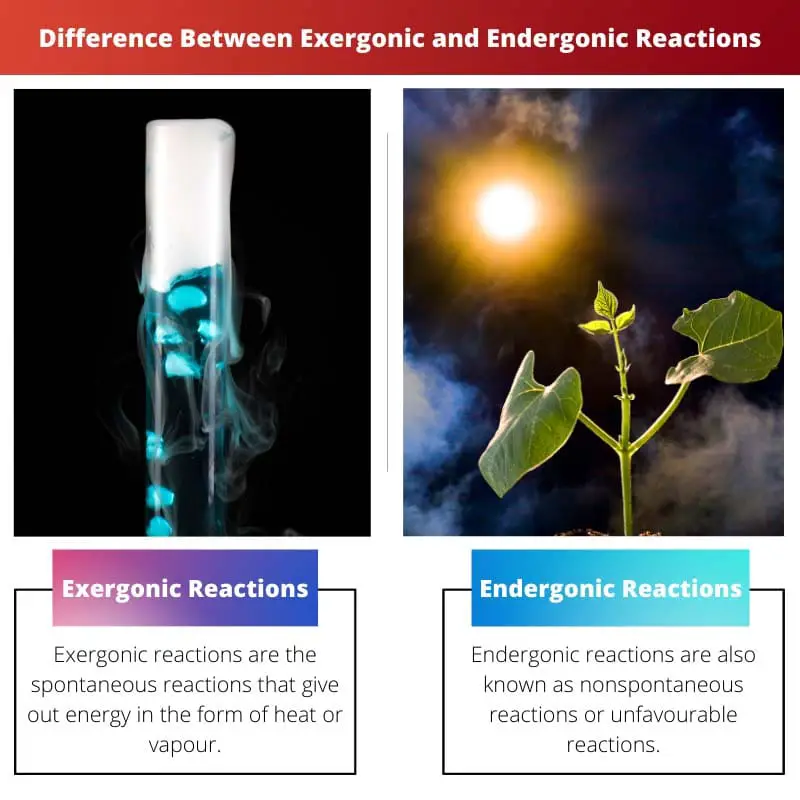
| Définition | Les réactions exergoniques sont les réactions spontanées qui dégagent de l'énergie sous forme de chaleur ou de vapeur. | Les réactions endergoniques sont également appelées réactions non spontanées ou réactions défavorables. La réaction nécessite plus d'énergie que vous n'en recevez |
| Énergie libre de Gibbs | La valeur de l'énergie libre de Gibbs est négative. | La valeur de Gibbs Free Energy est positive. |
| Niveau d'entropie | Le niveau d'entropie est augmenté dans une réaction exergonique typique. | L'entropie est diminuée dans une réaction endergonique. |
| Besoin énergétique | Donne de l'énergie sous forme de chaleur. | Absorbe de l'énergie à travers l'environnement pour initier la réaction ou la poursuivre. |
| Exemples | La réaction du sodium et du chlore pour produire du sel de table, la combustion et la chimiluminescence. Dans cette réaction, l'énergie est libérée sous forme de lumière. | La réaction chimique de la photosynthèse est un bon exemple de réactions endergoniques. |
Qu'est-ce que les réactions exergoniques ?
Les exergoniques sont des réactions irréversibles qui se produisent naturellement dans l'environnement. Le terme «spontané» fait référence à quelque chose de prêt ou désireux de se produire avec peu ou pas de stimulation externe.
Lorsqu'il est soumis à l'oxygène de l'atmosphère, le sodium, par exemple, brûle. Un autre exemple de réactions exergoniques est le fumage du bois.
Sous température et pression normales, l'énergie libre de Gibbs est nulle, ce qui indique que plus de chaleur est absorbée qu'absorbée. Ce sont des réponses irréversibles.
Les organismes vivants emploient des processus exergoniques pour transporter l'énergie du «stockage» dans un composant, comme la graisse ou le sucre, à un état activé, comme l'ATP.
Qu'est-ce que les réactions endergoniques ?
Un processus dans lequel la chaleur ou toute forme d'énergie est absorbée est connu sous le nom de réaction endergonique. Cela signifie que la variation globale de l'énergie libre est positive en termes chimiques.
De nombreux processus dans la nature ne peuvent avoir lieu que si une énergie adéquate de l'environnement est disponible.
Les aides énergétiques externes dans le la solution de ces connexions. L'énergie libérée à la suite de la rupture de la liaison alimente alors la réaction.
Dans le cas des réactions endergoniques, cette énergie libre de Gibbs est positive (+), indiquant que la réaction n'est pas spontanée.
Principales différences entre les réactions exergoniques et endergoniques
- Dans les réactions exergoniques, l'entropie augmente, tandis que dans les réactions endergoniques, l'entropie diminue.
- L'énergie des produits d'une réaction exergonique est supérieure à celle des réactifs, alors que l'énergie des produits est inférieure à celle des réactifs dans le cas des réactions endergoniques.
- https://www.khanacademy.org/science/biology/energy-and-enzymes/free-energy-tutorial/a/gibbs-free-energy
- https://bio.libretexts.org/Bookshelves/Introductory_and_General_Biology/Book%3A_General_Biology_(Boundless)/6%3A_Metabolism/6.2%3A_Potential_Kinetic_Free_and_Activation_Energy/6.2A%3A__Free_Energy
Dernière mise à jour : 07 septembre 2023

Piyush Yadav a passé les 25 dernières années à travailler comme physicien dans la communauté locale. C'est un physicien passionné par l'idée de rendre la science plus accessible à nos lecteurs. Il est titulaire d'un baccalauréat en sciences naturelles et d'un diplôme d'études supérieures en sciences de l'environnement. Vous pouvez en savoir plus sur lui sur son page bio.


Cet article présente une analyse approfondie des réactions exergoniques et endergoniques, mettant en lumière leur importance dans les interactions chimiques et biologiques.
Cet article fournit une explication perspicace et complète des réactions exergoniques et endergoniques. Le tableau de comparaison et les exemples sont particulièrement utiles pour comprendre les principales différences.
L'article est très informatif et bien structuré. La distinction claire entre les réactions exergoniques et endergoniques facilite la compréhension des concepts par les lecteurs.
L'élucidation de l'article sur les réactions exergoniques et endergoniques est louable, offrant aux lecteurs une compréhension approfondie des processus chimiques et biologiques qu'elles gouvernent.
L'article explique habilement la dichotomie entre les réactions exergoniques et endergoniques, illustrant leurs implications dans divers phénomènes naturels.
L'explication de l'article sur les réactions exergoniques et endergoniques est très articulée et éducative. Les exemples concrets fournis servent d’illustrations pratiques, contribuant à une meilleure compréhension du concept.
La comparaison complète entre les réactions exergoniques et endergoniques est louable, élucidant les principales disparités avec précision et clarté.
Le tableau comparatif détaillé met efficacement en évidence les disparités fondamentales entre les réactions exergoniques et endergoniques, s'adressant à des lecteurs ayant différents niveaux d'expertise. L’utilisation d’exemples descriptifs améliore encore la compréhension.