Dua jenis reaksi dijelaskan dengan kata endergonik dan eksergonik. Banyak interaksi kimia dan biologis terjadi secara terus-menerus baik di dalam maupun di luar tubuh manusia.
Artikel ini menggunakan tabel deskriptif untuk membedakan perbedaan mendasar dan lanjutan antara dua reaksi untuk kemudahan belajar dan pemahaman oleh pemula serta penggemar kimia.
Pengambilan Kunci
- Reaksi eksergonik melepaskan energi, sedangkan reaksi endergonik menyerap energi dari lingkungannya.
- Reaksi eksergonik memiliki perubahan energi bebas Gibbs negatif, sedangkan reaksi endergonik memiliki perubahan energi bebas Gibbs yang positif.
- Reaksi endergonik tidak spontan, sedangkan reaksi eksergonik spontan dalam kondisi tertentu.
Reaksi Eksergonik vs Reaksi Endergonik
Eksergonik reaksi adalah reaksi kimia yang perubahan energi bebasnya negatif, atau terjadi pelepasan energi bebas dan menunjukkan reaksi spontan. Reaksi endergonik adalah reaksi yang perubahan standar energi bebasnya positif, dan diperlukan gaya penggerak untuk melakukan hal ini.

Reaksi yang menghasilkan energi bebas dikenal sebagai reaksi 'eksergonik'. Karena reaksi ini menghasilkan energi daripada mengkonsumsinya, reaksi ini dapat terjadi dengan sendirinya, tanpa campur tangan kekuatan lain.
Reaksi eksergonik dalam biokimia, serta termokimia, adalah reaksi di mana perubahan energi bebasnya negatif (minus dalam nilai numerik).
Ini bukanlah reaksi yang tidak disengaja yang tidak spontan. Untuk memulai, mereka membutuhkan pengerahan tenaga atau input kekuatan – terutama dalam bentuk energi.
Peran umum dari reaksi endergonik adalah membebaskan energi dari molekul karbohidrat atau molekul makanan apa pun, memungkinkan makhluk untuk berkembang tanpa hanya mengandalkan sinar matahari untuk energi.
Tabel perbandingan
| Parameter Perbandingan | Reaksi Eksergonik | Reaksi Endergonik |
|---|---|---|
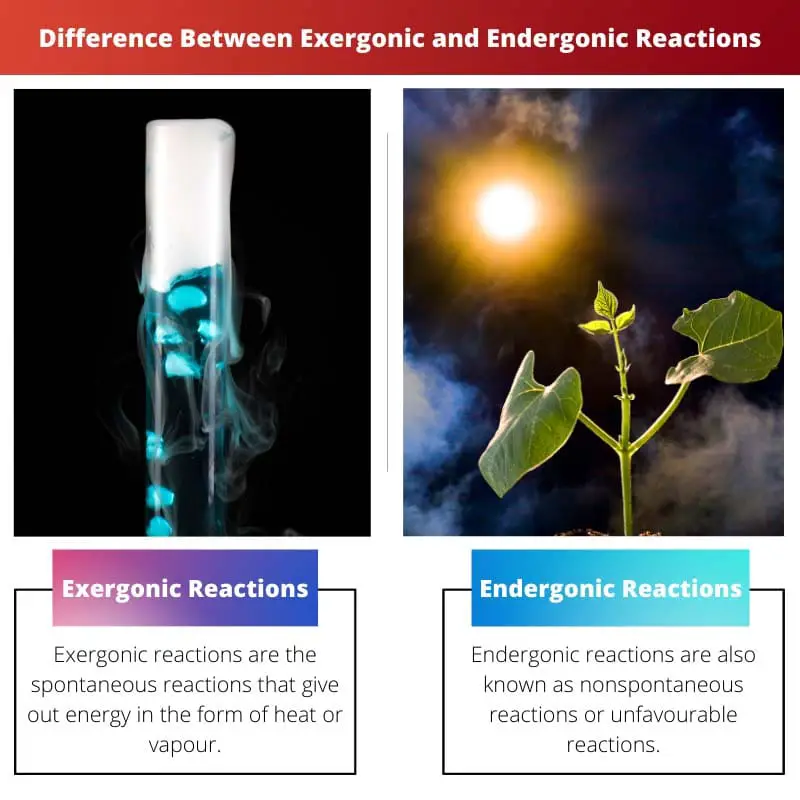
| Definisi | Reaksi eksergonik adalah reaksi spontan yang mengeluarkan energi dalam bentuk panas atau uap. | Reaksi endergonik juga dikenal sebagai reaksi tidak spontan atau reaksi yang tidak menguntungkan. Reaksi memerlukan energi lebih lanjut dari yang Anda terima |
| Energi Bebas Gibbs | Nilai Energi Bebas Gibbs negatif. | Nilai Energi Bebas Gibbs positif. |
| Tingkat Entropi | Tingkat entropi meningkat dalam reaksi eksergonik yang khas. | Entropi menurun dalam reaksi endergonik. |
| Kebutuhan Energi | Memberikan energi dalam bentuk panas. | Memasukkan energi melalui lingkungan untuk inisiasi reaksi atau kelanjutannya. |
| contoh | Reaksi natrium dan klorin untuk membuat garam meja, pembakaran, dan chemiluminescence. Dalam reaksi ini energi dilepaskan dalam bentuk cahaya. | Reaksi kimia fotosintesis adalah contoh yang baik untuk reaksi endergonik. |
Apa itu Reaksi Eksergonik?
Eksergonik adalah reaksi ireversibel yang terjadi secara alami di lingkungan. Istilah "spontan" mengacu pada sesuatu yang siap atau ingin terjadi dengan sedikit atau tanpa rangsangan eksternal.
Saat terkena oksigen di atmosfer, natrium, misalnya, akan terbakar. Contoh lain dari reaksi eksergonik adalah pengasapan kayu.
Di bawah suhu dan tekanan standar, energi bebas Gibbs adalah nol, menunjukkan bahwa lebih banyak panas yang diambil daripada yang diserap. Ini adalah tanggapan yang tidak dapat dibalik.
Organisme hidup menggunakan proses eksergonik untuk mengangkut energi dari “penyimpanan” dalam satu komponen, seperti lemak atau gula, ke keadaan aktif, seperti ATP.
Apa itu Reaksi Endergonik?
Suatu proses di mana panas atau segala bentuk energi diserap dikenal sebagai reaksi endergonik. Ini berarti bahwa keseluruhan perubahan energi bebas adalah positif dalam istilah kimia.
Banyak proses di alam hanya dapat berlangsung jika energi yang cukup dari lingkungan tersedia.
Bantuan energi eksternal dalam pembubaran dari koneksi ini. Energi yang dilepaskan sebagai akibat dari pemutusan ikatan kemudian memicu reaksi.
Dalam contoh reaksi endergonik, energi bebas Gibbs ini positif (+), menunjukkan bahwa reaksi tersebut tidak spontan.
Perbedaan Utama Antara Reaksi Eksergonik dan Endergonik
- Pada reaksi eksergonik, entropi meningkat, sedangkan pada reaksi endergonik, entropi menurun.
- Energi produk reaksi eksergonik lebih besar dibandingkan energi reaktan, sedangkan energi produk lebih kecil dibandingkan energi reaktan pada reaksi endergonik.
- https://www.khanacademy.org/science/biology/energy-and-enzymes/free-energy-tutorial/a/gibbs-free-energy
- https://bio.libretexts.org/Bookshelves/Introductory_and_General_Biology/Book%3A_General_Biology_(Boundless)/6%3A_Metabolism/6.2%3A_Potential_Kinetic_Free_and_Activation_Energy/6.2A%3A__Free_Energy
Terakhir Diperbarui : 07 September 2023

Piyush Yadav telah menghabiskan 25 tahun terakhir bekerja sebagai fisikawan di masyarakat setempat. Dia adalah fisikawan yang bersemangat membuat sains lebih mudah diakses oleh pembaca kami. Dia memegang gelar BSc dalam Ilmu Pengetahuan Alam dan Diploma Pasca Sarjana dalam Ilmu Lingkungan. Anda dapat membaca lebih lanjut tentang dia di nya halaman bio.


Artikel ini menyajikan analisis menyeluruh tentang reaksi eksergonik dan endergonik, menyoroti signifikansinya dalam interaksi kimia dan biologis.
Artikel ini memberikan penjelasan mendalam dan komprehensif tentang reaksi eksergonik dan endergonik. Tabel perbandingan dan contoh-contohnya sangat membantu dalam memahami perbedaan utama.
Artikel ini sangat informatif dan terstruktur dengan baik. Perbedaan yang jelas antara reaksi eksergonik dan endergonik memudahkan pembaca memahami konsepnya.
Penjelasan artikel tentang reaksi eksergonik dan endergonik patut dipuji, karena menawarkan pemahaman yang baik kepada pembaca tentang proses kimia dan biologis yang diaturnya.
Artikel ini dengan cerdik menjelaskan dikotomi antara reaksi eksergonik dan endergonik, serta memberikan contoh implikasinya dalam berbagai fenomena alam.
Penjelasan artikel mengenai reaksi eksergonik dan endergonik sangat lugas dan mendidik. Contoh-contoh kehidupan nyata yang diberikan berfungsi sebagai ilustrasi praktis, berkontribusi pada pemahaman konsep yang lebih baik.
Perbandingan komprehensif antara reaksi eksergonik dan endergonik patut dipuji karena mampu menjelaskan perbedaan inti dengan tepat dan jelas.
Tabel perbandingan terperinci secara efektif menyoroti perbedaan mendasar antara reaksi eksergonik dan endergonik, sehingga dapat melayani pembaca dengan berbagai tingkat keahlian. Penggunaan contoh deskriptif semakin meningkatkan pemahaman.