食べ物に含まれる栄養素はすぐに体に吸収されません。 それらは、さまざまな酵素によってより小さな部分に分解される必要があります。
タンパク質の場合、特定の酵素がそれらを体が使用するアミノ酸に分解するのを助けます. これらの酵素には、キモトリプシンとトリプシンの XNUMX 種類があります。
主要な取り組み
- キモトリプシンは、芳香族アミノ酸でペプチド結合を切断するタンパク質分解酵素です。
- トリプシンは、塩基性アミノ酸のペプチド結合を標的とする別のタンパク質分解酵素です。
- 両方の酵素は、消化器系内のタンパク質消化において重要な役割を果たします.
キモトリプシン vs トリプシン
キモトリプシンは、タンパク質をより小さなペプチドとアミノ酸に分解する消化酵素です。 トリプシン切断 ペプチド 必須アミノ酸のカルボキシル側に結合します。 トリプシンは膵臓で生成され、小腸でのタンパク質の消化に重要です。

キモトリプシンは、タンパク質を分解することによって消化プロセスを本質的に助ける酵素です。 膵液の構成成分として膵臓から分泌されます。
この酵素は、キモトリプシノーゲンと呼ばれるその前駆体によって活性化されます。 これは、トリプシンの存在下でのみ機能する不活性酵素です。
一方、トリプシンは、さまざまなアミノ酸で機能する別の種類の消化酵素です。 膵臓からも作られます。
しかし、その働きのほとんどは小腸で行われています。 その前駆体は、トリプシノーゲンと呼ばれる不活性酵素です。 不活性酵素は、エンテロキナーゼの存在下でのみ機能します。
比較表
| 比較のパラメータ | キモトリプシン | トリプシン |
|---|---|---|
| Discovery | 1900年代に発見されました。 | 1876年に発見されました。 |
| 意味 | 芳香族アミノ酸を分解する消化酵素です。 | 塩基性アミノ酸を分解する消化酵素です。 |
| 前駆 | その前駆体は、キモトリプシノーゲンと呼ばれる不活性酵素です。 | その前駆体は、トリプシノーゲンと呼ばれる不活性酵素です。 |
| アクティベーション | その前駆体は、トリプシンの助けを借りて活性化されます。 | その前駆体は、エンテロキナーゼの助けを借りて活性化されます。 |
| アミノ酸 | チロシン、トリプトファン、フェニルアラニンなどのアミノ酸を選択します。 | アルギニンやリジンなどのアミノ酸を選択します。 |
| あなたが使用します | ペプチドマッピング、ペプチド合成、分析、さらにはフィンガープリンティングにも使用できます。 | 組織解離、ミトコンドリア分離、細胞採取に使用できます。 |
| 阻害剤 | その阻害剤には、ベンザミジン、アプロチニン、DFP、EDTA、Ag+ などがあります。 | その阻害剤には、ボロン酸、ペプチジルアルデヒド、クマリン誘導体などがあります。 |
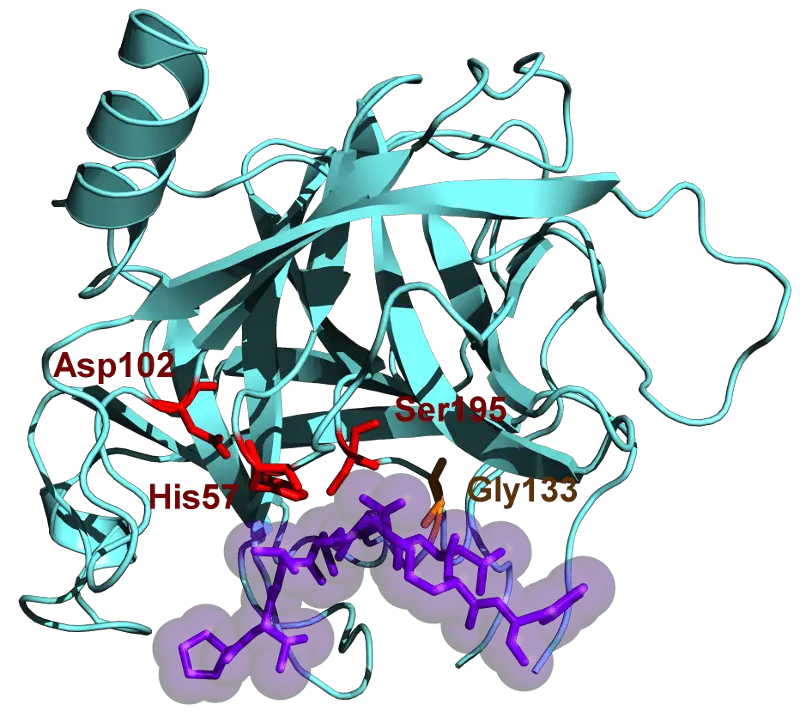
キモトリプシンとは何ですか?
キモトリプシンは、1900 年代に初めて発見された消化酵素です。 これはセリンプロテアーゼファミリーの一部であり、エンドペプチダーゼのカテゴリーに分類されます。
酵素には、 分子量 25.6kDaの。 その前駆体はキモトリプシノーゲンと呼ばれます。 これは、トリプシンの助けを借りて活性化する不活性酵素です。
これが起こると、キモトリプシンが形成され、膵液の成分として膵臓から放出されます。
すべての酵素は、特定の構造とサイズが内部に収まるように構築された活性部位を内部に持っています. これは、酵素がそれらの中に収まる特定のアミノ酸を選択する必要があることを意味します.
キモトリプシンの場合、芳香族アミノ酸のみが選択されます。
これらには、チロシン、トリプトファン、およびフェニルアラニンが含まれます。 それらが酵素の活性部位に入ると、消化できるようにペプチド結合が切断されます。
これらの酵素は、医療および Vito 研究においてさまざまな目的に役立ちます。 それらは、ペプチド マッピング、ペプチド合成、分析、さらにはフィンガープリンティングにも使用されます。
キモトリプシンと結合してその活性を低下させる特定の阻害剤もあります。 これらには、ベンザミジン、アプロチニン、DFP、EDTA、Ag+ などが含まれます。
これらは、キモトリプシン酵素が機能不全に陥っている人に処方されるサプリメントに含まれています。
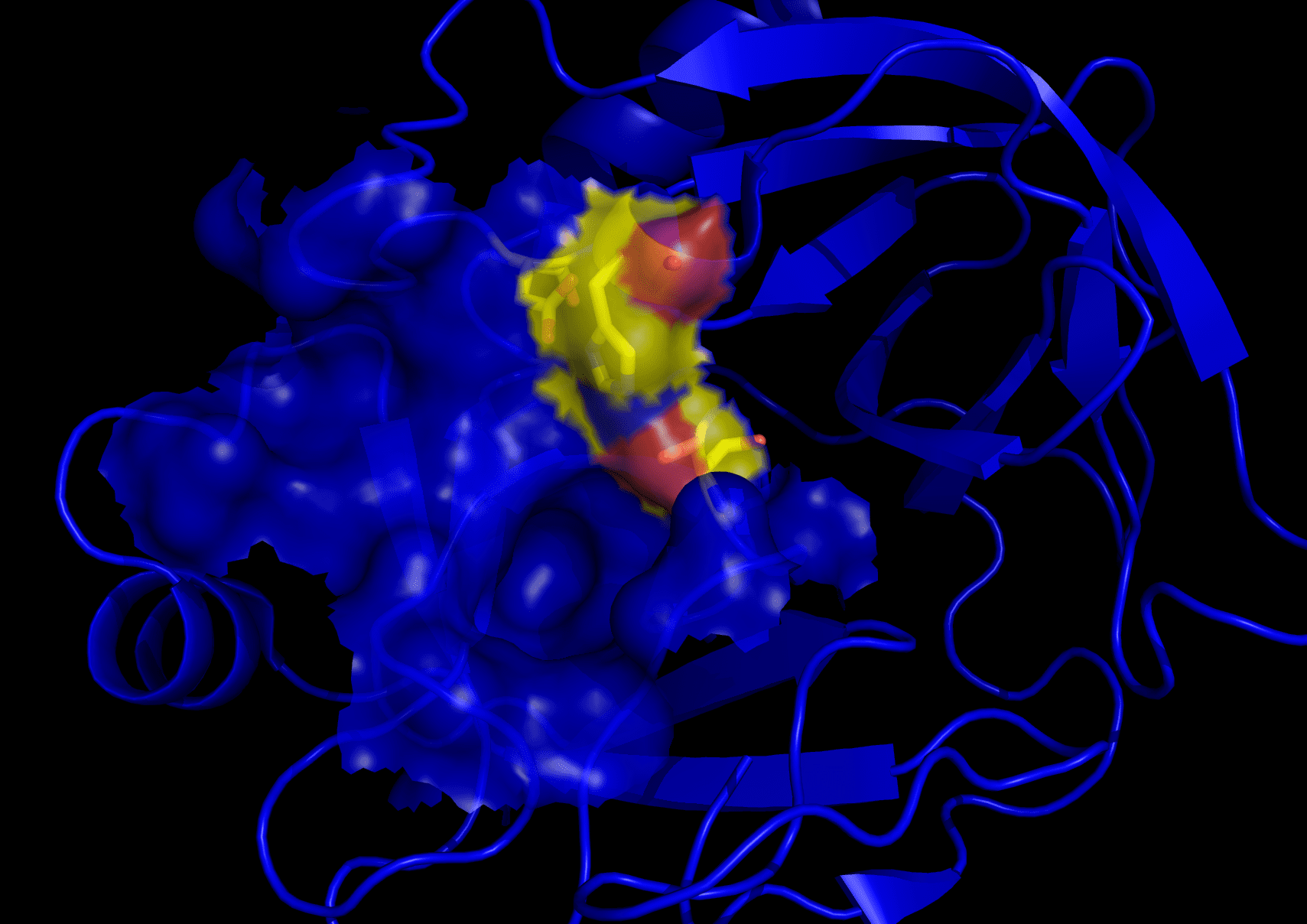
トリプシンとは何?
トリプシンは別の消化酵素ですが、1876 年に発見されました。これもセリンプロテアーゼファミリーに属しますが、球状タンパク質のカテゴリーに分類されます。
トリプシンの分子量は 23.3 kDa です。 その機能は、アミノ酸のペプチド結合を切断することです。
この酵素は、トリプシノーゲンと呼ばれる前駆体から膵臓から放出されます。
この不活性酵素は、活性化のためにエンテロキナーゼと接触します。 これが起こると、それは小腸に運ばれ、そこでほとんどの機能が行われます.
この酵素は、特定の塩基性アミノ酸のみを活性部位に選択します。 これらには、アルギニンとリジンが含まれます。
トリプシンは、組織解離、ミトコンドリア分離、および細胞採取においてさまざまな用途があります。 また、ボロン酸、ペプチジルアルデヒド、クマリン誘導体などを含むいくつかの阻害剤も含まれています.
これらは、多くの医療用途を持つさまざまなサプリメントに含まれています.
トリプシンには、主に XNUMX つのタイプがあります。 これらには、アルファトリプシンとベータトリプシンが含まれます。 それらのそれぞれは、異なる熱安定性しきい値で異なる構造と機能を持っています。
ただし、どちらの活性部位にもアスパラギン酸、ヒスチジン、およびセリンが含まれており、アミノ酸を分解するプロセス全体に役立ちます. それらは、炭素を持っているc末端を切断することによってそうします.
キモトリプシンとトリプシンの主な違い
- キモトリプシンは 1900 年代に発見されましたが、トリプシンは 1876 年に発見されました。
- キモトリプシンは芳香族アミノ酸を分解する消化酵素ですが、トリプシンは塩基性アミノ酸を分解する消化酵素です。
- キモトリプシンはチロシン、トリプトファン、フェニルアラニンなどのアミノ酸を選択しますが、トリプシンはアルギニンやリジンなどのアミノ酸を選択します。
- の前駆体 キモトリプシンはキモトリプシノーゲンと呼ばれる不活性酵素ですが、トリプシンはトリプシノーゲンと呼ばれる不活性酵素です。
- キモトリプシンの前駆体はトリプシンの助けを借りて活性化されますが、トリプシンの前駆体はエンテロキナーゼの助けを借りて活性化されます.
- キモトリプシンは、ペプチド マッピング、ペプチド合成、分析、さらにはフィンガープリンティングにも使用できますが、トリプシンは組織解離、ミトコンドリア分離、および細胞採取に使用できます。
- キモトリプシン阻害剤には、ベンザミジン、アプロチニン、DFP、EDTA、Ag+ などがありますが、トリプシン阻害剤には、ボロン酸、ペプチジルアルデヒド、クマリン誘導体などがあります。
- https://www.sciencedirect.com/science/article/pii/0022283672900289
- https://www.sciencedirect.com/science/article/pii/0014579395014845
最終更新日 : 11 年 2023 月 XNUMX 日

Piyush Yadav は、過去 25 年間、地元のコミュニティで物理学者として働いてきました。 彼は、読者が科学をより身近なものにすることに情熱を傾ける物理学者です。 自然科学の学士号と環境科学の大学院卒業証書を取得しています。 彼の詳細については、彼のウェブサイトで読むことができます バイオページ.


2 つの酵素の優れた詳細な比較。非常に有益でよく書かれています。
はい、とても有益な記事です。 2 つの酵素の違いがよく説明されています。
このことから多くのことを学びました。正確な情報なので理解しやすいです。
この記事は、キモトリプシンとトリプシンについての優れた洞察を提供します。本当に教育的です。
非常によく研究されており、有益です。このトピックに興味がある人は必読の書です。
この記事は非常に啓発的で明確だと思いました。この 2 つの酵素にこれほどの違いがあるとは知りませんでした。
キモトリプシンとトリプシンの非常に徹底的な比較に同意します。
はい、記事は正確なので、非常に有益な読み物になります。
これら 2 つの消化酵素の詳細な比較は興味深いものです。とても啓発的な読み物。
両方の酵素の詳細な内訳が非常に明確で役に立ちます。
同意します。記事はよく構成されており、理解しやすいです。
はい、このトピックに関する素晴らしい情報源です。
よく研究された文章。共有してくれてありがとう!
キモトリプシンとトリプシンの違いについて包括的に考察していただきありがとうございます。