Het periodiek systeem van scheikunde is iets dat studenten wordt gevraagd om moeizaam uit het hoofd te leren zonder zelfs maar het werkelijke motief achter het leren ervan te kennen. Voor sommige mensen is het gewoon een onderwerp in hun syllabus.
Maar in feite is dit kleine periodiek systeem veel belangrijker dan dat; het is een routekaart die een miljoen kansen ontsluit voor wetenschappers en onderzoekers over de hele wereld. Dmitri Mendeleyev is de uitvinder van het periodiek systeem.
Voor hem deden velen hun best om chemische elementen op verschillende manieren te rangschikken. Maar de uitkomst van Dmitri werd wereldwijd geaccepteerd.
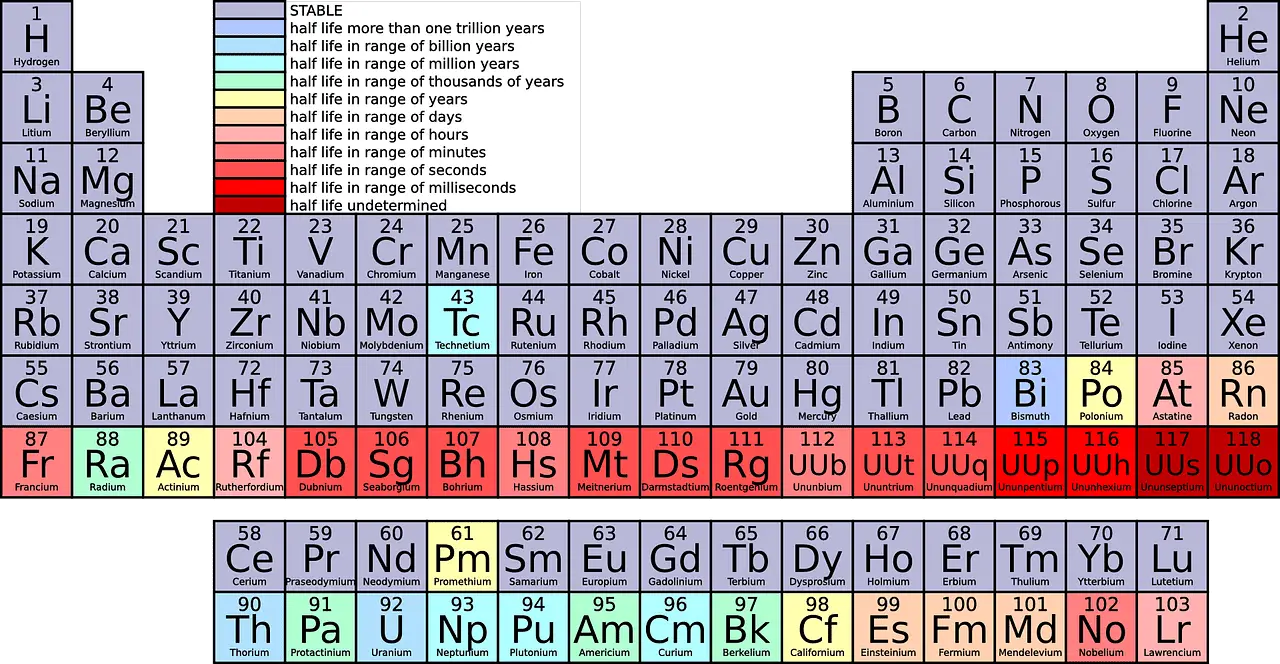
In wetenschappelijke afkortingen worden de rijen respectievelijk perioden en de kolommen groepen genoemd.
Key Takeaways
- Perioden zijn de horizontale rijen in het periodiek systeem, die het aantal elektronenschillen in de atomen van een element aangeven, waarbij elementen in dezelfde periode vergelijkbare atomaire structuren hebben.
- Groepen zijn de verticale kolommen in het periodiek systeem, bestaande uit elementen met hetzelfde aantal elektronen in hun buitenste schil, wat leidt tot vergelijkbare chemische eigenschappen.
- Zowel perioden als groepen organiseren elementen in het periodiek systeem, met perioden die horizontale rijen vertegenwoordigen op basis van elektronenschillen en groepen die verticale kolommen vertegenwoordigen op basis van buitenste schilelektronen en chemische eigenschappen.
Periode versus Groep
Een punt is een horizontale rij die van de linkerkant naar de rechterkant van het periodiek systeem gaat, en de elektronegativiteit neemt toe. Een groep is een verticaal kolom dat gaat van de bovenkant van het periodiek systeem naar de onderkant, en de elektronegativiteit neemt toe van onder naar boven.

Tijdens het arrangeren liet Mendelejev een paar rijen leeg met de indruk dat er in de nabije toekomst nog enkele andere elementen zouden binnenkomen. En verrassend genoeg was een van de elementen die in die opening paste Gallium.
Vergelijkingstabel
| Parameter van vergelijking | Periode | Groep |
|---|---|---|
| Aanwijzingen | Periodes zijn de horizontale rijen op het moderne periodiek systeem | Groepen zijn de verticale kolommen die door de bovenkant van het periodiek systeem lopen |
| Properties | De elementen in een periode hebben geen vergelijkbare eigenschappen. | De elementen in elke groep hebben enkele vergelijkbare eigenschappen, maar niet identieke eigenschappen. |
| gelijkenis | Elementen in dezelfde periode hebben een gelijk aantal elektronensamenstelling | Elementen in elke groep hebben een gelijk aantal valentie-elektronen |
| Som | Er zijn 7 perioden op het periodiek systeem | De groep bevat 18 elementen die verticaal zijn gerangschikt in het moderne periodiek systeem. |
| Elektronegativiteit | Het stijgt van links naar rechts. | Het stijgt van onder naar boven in een groep. |
Wat is periode?
Een punt is een horizontale rij van uiterst links naar uiterst rechts op het periodiek systeem. Vanaf nu zijn er 7 perioden op het periodiek systeem.
Een nieuwe periode begint wanneer een nieuw fundamenteel energieniveau optelt met de elektronen. Elk element in een periode zal waarschijnlijk een gelijk aantal atomaire orbitalen hebben.
Bijvoorbeeld – elk element in de 1st periode heeft er maar 1 orbitale voor zijn elektronen, 2nd periode omvat 2 orbitalen voor de elektronen. Evenzo blijven orbitalen optellen terwijl u naar beneden gaat in de rij.
De grootte van het element neemt af naarmate je over een periode beweegt, aangezien het aantal elektronenschillen constant blijft, maar het aantal protonen in de kern stijgt. Dit is de reden waarom het atoom zwaarder wordt, maar de grootte steeds kleiner wordt.
Als je naar het periodiek systeem kijkt, zie je verschillende elementen in elke rij passen. De 1e periode heeft slechts 2 elementen (1 & 18), de 2e en 3e periode hebben elk 8 elementen, de 4e en 5e periode hebben respectievelijk 18 elementen en de 6e en 7e periode hebben elk 32 elementen.
Wat is Groep?
Van boven naar beneden geteld, zijn er 18 groepen in het periodiek systeem. Alle groepen krijgen verschillende namen toegewezen.
De groepen zijn gemengde categorieën van metalen, niet-metalen en semi-metalen, gegroepeerd in families op basis van hun vergelijkbare eigenschappen. Groep 1 behoort bijvoorbeeld tot de lithiumfamilie, geclassificeerd als alkeenmetalen.
Evenzo heeft elke groep in de baan zijn familienaam. Elementen in de verwante groep hebben vergelijkbare eigenschappen omdat ze hetzelfde aantal elektronen in hun buitenste schillen hebben.
De grootte van het element neemt toe naarmate u een groep naar beneden verplaatst. Dit komt omdat er in de kern grote aantallen protonen en neutronen voorkomen.
Bovendien maakt een extra elektronenschil het atoom zwaarder. Voor groepen zijn er twee verschillende manieren om de elementen te illustreren.
Het begrijpen van beide nummeringssystemen is essentieel omdat het periodiek systeem in beide formaten voorkomt. In de Verenigde Staten gebruikten ze de letters A&B om elk element in de groep aan te duiden, maar helaas werd dit gezien als een ongeorganiseerd nummeringssysteem.
Om alle mogelijke verwarring uit te sluiten, heeft de International Unie of Pure and Applied Chemistry (IUPAC) Kwam op het idee om de elementen te nummeren als (1,2, 3... 18). Beide nummeringssystemen zijn echter acceptabel. Maar de nummering van IUPAC ziet er overzichtelijk en duidelijk uit.
Belangrijkste verschillen tussen Periode en groep
- Locatie: Groepen zijn de rechtopstaande kolom, terwijl Perioden de rechte rijen in het periodiek systeem zijn.
- Aantal: Er zijn in totaal 18 groepen en 7 perioden in het periodiek systeem, waaronder de groepen zijn onderverdeeld in verschillende families en metaalsoorten.
- Chemische eigenschappen: Alle elementen in de groep hebben analoge chemische of fysische eigenschappen, terwijl perioden dezelfde elektronenhiërarchie delen.
- Energie level: Naarmate we van boven naar beneden de groep afdalen, neemt het energieniveau van elektronen toe. Aan de andere kant blijft het energieniveau van het elektron in elke periode hetzelfde.
- Elektronegativiteit: Dit daalt van boven naar beneden in een groep en stijgt van links naar rechts in een periode. Dit is een essentiële overweging bij het bestuderen van het periodiek systeem.

Laatst bijgewerkt: 11 juni 2023

Piyush Yadav heeft de afgelopen 25 jaar als natuurkundige in de lokale gemeenschap gewerkt. Hij is een natuurkundige die gepassioneerd is om wetenschap toegankelijker te maken voor onze lezers. Hij heeft een BSc in natuurwetenschappen en een postdoctoraal diploma in milieuwetenschappen. Je kunt meer over hem lezen op zijn bio pagina.

Geweldig artikel! Dit geeft een goed inzicht in het belang van het periodiek systeem. Ik heb er echt van genoten!
Ik ben erg blij dat je het nuttig vond. Dat deed ik ook!
Absoluut, elke bètastudent zou dit moeten lezen.
Zeer informatief bericht. We moeten aandringen op beter onderwijs en beter begrip van wetenschappelijke onderwerpen.
Dit is precies wat we nodig hebben.
Dit is slechts een voorbeeld van verouderde onderwijsnormen. We zouden studenten relevantere onderwerpen moeten leren.
Ik geloof dat het van cruciaal belang is dat leerlingen het periodiek systeem begrijpen.
Dat is een controversieel standpunt, Joel.
Ik denk dat mensen de waarde van het periodiek systeem onderschatten. We zouden meer moeten doen om ons onderwijs hierover te verbeteren.
Absoluut, dit is een belangrijk punt.
Ik vind het heel interessant dat zo'n ogenschijnlijk eenvoudige tabel zoveel waardevolle informatie kan bevatten.
Ja, het is behoorlijk fascinerend.
Dit is verhelderend. Het periodiek systeem wordt onderschat.
Dit was een broodnodige lectuur om mijn dag te beginnen!
Er worden hier enkele geldige punten gepresenteerd, maar ik ben nog steeds niet overtuigd van het belang van het periodiek systeem.
Ik ben het met je eens, Zak.
Het periodiek systeem is een hoeksteen van de scheikunde en moet als zodanig worden behandeld.
Ik ben het er niet meer mee eens.
Ik ben het daar niet mee eens, ik ben van mening dat het onderwijzen van het periodiek systeem op de huidige manier achterhaald is en herzien moet worden.
Ik begrijp waarom sommigen het misschien verouderd vinden, maar het is echt van vitaal belang voor de wetenschappelijke ontwikkeling.
Ik begrijp wat je zegt, maar ik ben het er niet helemaal mee eens.
Hoewel ik het belang van het periodiek systeem begrijp, is het moeilijk te beargumenteren dat het huidige onderwijssysteem adequaat is.
Je brengt een belangrijk punt naar voren, Erin.