Питательные вещества в пище не могут сразу усваиваться организмом. Они должны быть разбиты на более мелкие части различными ферментами.
В случае белков специальные ферменты помогают расщеплять их на аминокислоты, которые использует организм. Эти ферменты бывают двух типов, а именно химотрипсин и трипсин.
Основные выводы
- Химотрипсин — протеолитический фермент, расщепляющий пептидные связи ароматических аминокислот.
- Трипсин — еще один протеолитический фермент, нацеленный на пептидные связи основных аминокислот.
- Оба фермента играют важную роль в переваривании белков в пищеварительной системе.
Химотрипсин против трипсина
Химотрипсин — пищеварительный фермент, расщепляющий белки на более мелкие пептиды и аминокислоты. Трипсин расщепляет пептид связи на карбоксильной стороне незаменимых аминокислот. Трипсин вырабатывается поджелудочной железой и важен для переваривания белков в тонком кишечнике.

Химотрипсин — это фермент, который существенно помогает процессу пищеварения, расщепляя белки. Выделяется поджелудочной железой в составе панкреатического сока.
Фермент активируется своим предшественником, который называется химотрипсиногеном. Это неактивный фермент, который функционирует только в присутствии трипсина.
Между тем, трипсин — это еще один тип пищеварительного фермента, который работает с различными аминокислотами. Он также вырабатывается поджелудочной железой.
Однако большая часть его работы осуществляется в тонкой кишке. Его предшественником является неактивный фермент трипсиноген. Неактивный фермент функционирует только в присутствии энтерокиназы.
Сравнительная таблица
| Параметры сравнения | Chymotrypsin | трипсин |
|---|---|---|
| Открытие | Он был обнаружен в 1900-х годах. | Он был обнаружен в 1876 году. |
| Смысл | Это пищеварительный фермент, расщепляющий ароматические аминокислоты. | Это пищеварительный фермент, который расщепляет основные аминокислоты. |
| Предшественник | Его предшественником является неактивный фермент химотрипсиноген. | Его предшественником является неактивный фермент трипсиноген. |
| Активация | Его предшественник активируется с помощью трипсина. | Его предшественник активируется с помощью энтерокиназы. |
| Аминокислоты | Он выбирает аминокислоты, включая тирозин, триптофан и фенилаланин. | Он выбирает аминокислоты, включая аргинин и лизин. |
| Пользы | Его можно использовать для картирования пептидов, синтеза пептидов, анализа и даже снятия отпечатков пальцев. | Его можно использовать для диссоциации тканей, выделения митохондрий и сбора клеток. |
| Ингибиторы | К его ингибиторам относятся бензамидин, апротинин, ДФП, ЭДТА, Ag+ и др. | К его ингибиторам относятся бороновые кислоты, пептидилальдегиды, производные кумарина и др. |
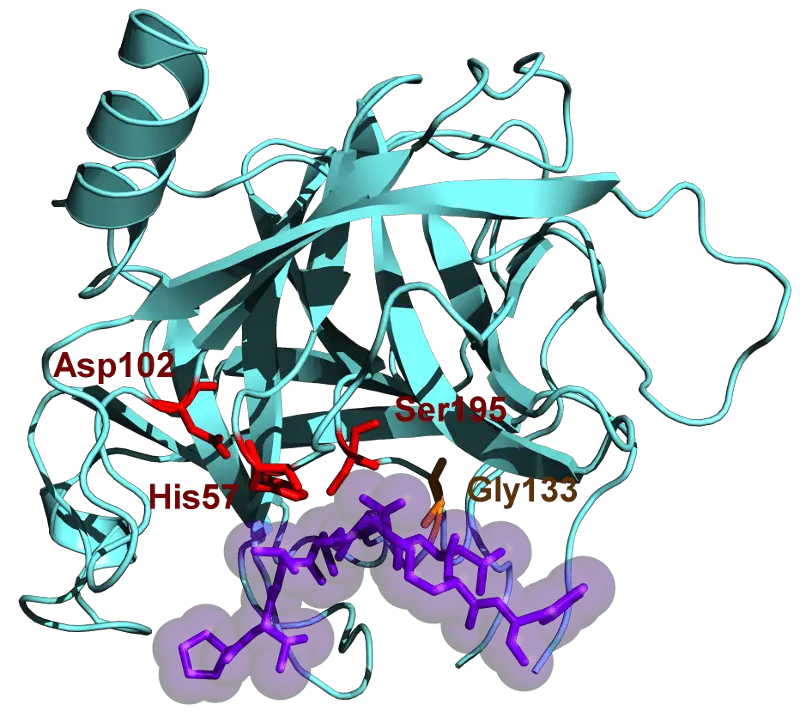
Что такое химотрипсин?
Химотрипсин — пищеварительный фермент, впервые открытый в 1900-х годах. Он является частью семейства сериновых протеаз и подпадает под категорию эндопептидаз.
Фермент имеет молекулярная масса 25.6 кДа. Его предшественник называется химотрипсиноген. Это неактивный фермент, который активируется с помощью трипсина.
Когда это происходит, химотрипсин образуется и высвобождается из поджелудочной железы в составе панкреатического сока.
Внутри каждого фермента есть активный центр, построенный для определенных структур и размеров, чтобы поместиться внутри. Это означает, что фермент должен выбрать определенные аминокислоты, которые могут поместиться внутри них.
В случае химотрипсина выбирают только ароматические аминокислоты.
К ним относятся тирозин, триптофан и фенилаланин. Как только они попадают в активный центр фермента, их пептидные связи разрываются, чтобы их можно было переварить.
Эти ферменты служат различным целям в медицинских исследованиях и исследованиях Вито. Они используются для картирования пептидов, синтеза пептидов, анализа и даже снятия отпечатков пальцев.
Существуют также определенные ингибиторы, которые связываются с химотрипсином, чтобы снизить его активность. К ним относятся бензамидин, апротинин, ДФП, ЭДТА, Ag+ и др.
Они содержатся в добавках, которые назначают людям с дисфункциональными ферментами химотрипсина.
Что такое трипсин?
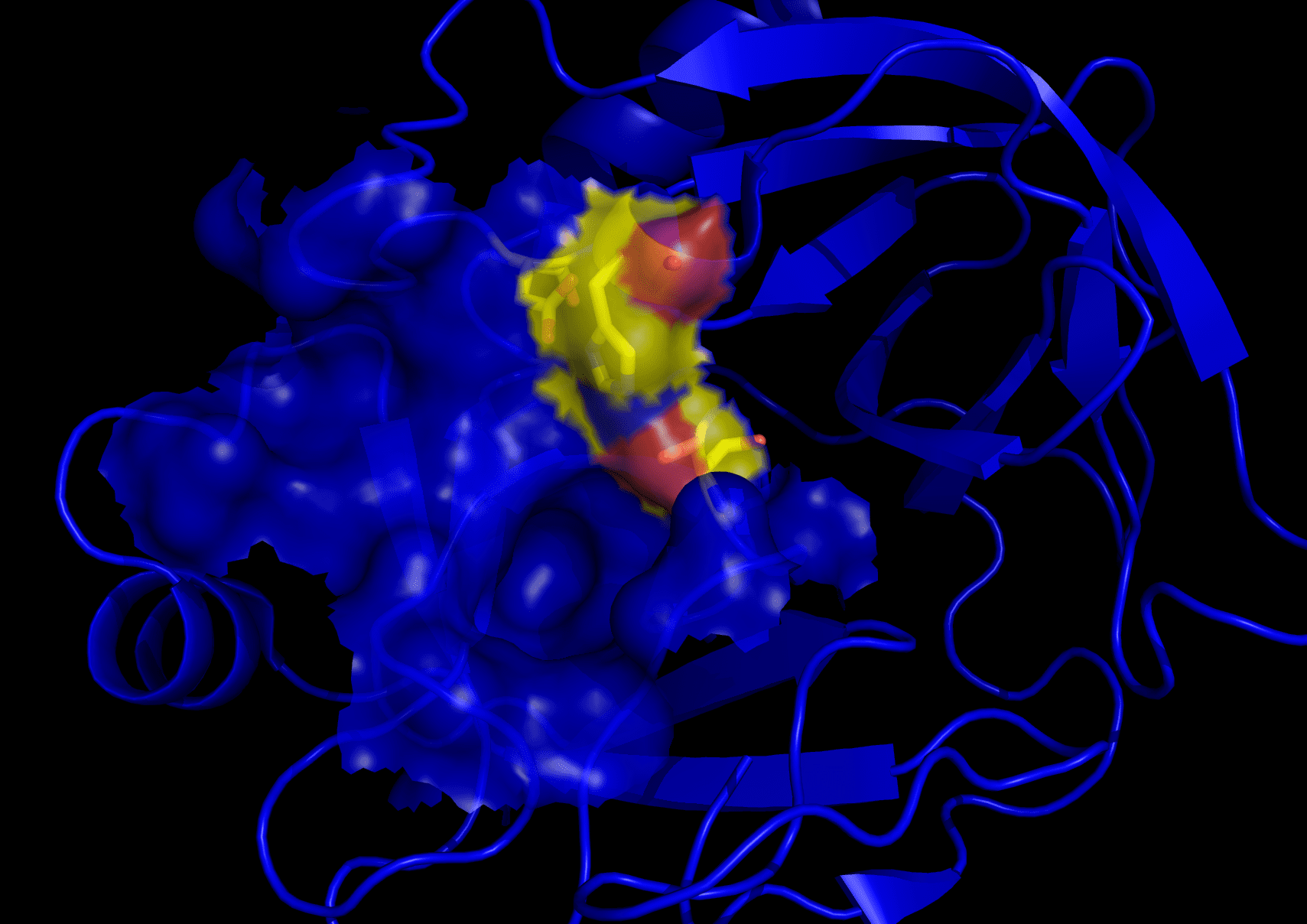
Трипсин — еще один пищеварительный фермент, но он был открыт намного раньше, в 1876 году. Он также принадлежит к семейству сериновых протеаз, но относится к категории глобулярных белков.
Молекулярная масса трипсина составляет 23.3 кДа. Его функция заключается в разрыве пептидных связей в аминокислотах.
Фермент высвобождается поджелудочной железой из своего предшественника, называемого трипсиногеном.
Этот неактивный фермент вступает в контакт с энтерокиназой для активации. Как только это происходит, он переносится в тонкую кишку, где и происходит большая часть его функционирования.
Фермент выбирает только определенные основные аминокислоты в свой активный центр. К ним относятся аргинин и лизин.
Трипсин имеет различное применение для диссоциации тканей, выделения митохондрий и сбора клеток. Он также имеет несколько ингибиторов, в том числе бороновые кислоты, пептидилальдегиды, производные кумарина и т. д.
Они содержатся в различных добавках, которые имеют многочисленные медицинские применения.
Трипсин бывает двух основных типов. К ним относятся альфа-трипсин и бета-трипсин. Каждый из них имеет разную структуру и функционирует при разном пороге термической стабильности.
Однако оба их активных центра содержат аспарагиновую кислоту, гистидин и серин, которые помогают во всем процессе расщепления аминокислот. Они делают это, расщепляя С-конец, на котором есть углерод.
Основные различия между химотрипсином и трипсином
- Химотрипсин был открыт в 1900-х годах, тогда как трипсин был открыт в 1876 году.
- Химотрипсин — пищеварительный фермент, расщепляющий ароматические аминокислоты, тогда как трипсин — пищеварительный фермент, расщепляющий основные аминокислоты.
- Химотрипсин выбирает аминокислоты, включая тирозин, триптофан и фенилаланин, тогда как трипсин выбирает аминокислоты, включая аргинин и лизин.
- Ассоциация предшественник химотрипсин представляет собой неактивный фермент, называемый химотрипсиногеном, тогда как трипсин представляет собой неактивный фермент, называемый трипсиногеном.
- Предшественник химотрипсина активируется с помощью трипсина, тогда как предшественник трипсина активируется с помощью энтерокиназы.
- Химотрипсин можно использовать для картирования пептидов, синтеза пептидов, анализа и даже снятия отпечатков пальцев, тогда как трипсин можно использовать для диссоциации тканей, выделения митохондрий и сбора клеток.
- Ингибиторы химотрипсина включают бензамидин, апротинин, ДФП, ЭДТА, Ag+ и др., тогда как ингибиторы трипсина включают бороновые кислоты, пептидилальдегиды, производные кумарина и др.
- https://www.sciencedirect.com/science/article/pii/0022283672900289
- https://www.sciencedirect.com/science/article/pii/0014579395014845
Последнее обновление: 11 июня 2023 г.

Пиюш Ядав последние 25 лет работал физиком в местном сообществе. Он физик, увлеченный тем, чтобы сделать науку более доступной для наших читателей. Он имеет степень бакалавра естественных наук и диплом о высшем образовании в области наук об окружающей среде. Подробнее о нем можно прочитать на его био страница.

Отличное детальное сравнение двух ферментов. Очень информативно и хорошо написано.
Да, это очень информативная статья. Хорошо объясненные различия между двумя ферментами.
Я многому научился из этого. Точная информация облегчает понимание.
Эта статья дает отличное представление о химотрипсине и трипсине. Действительно познавательно.
Очень хорошо исследовано и информативно. Обязательно к прочтению всем, кто интересуется этой темой.
Я нашел эту статью очень поучительной и ясной. Я понятия не имел, что между этими двумя ферментами существует такая разница.
Согласен, очень тщательное сравнение химотрипсина и трипсина.
Да, точность статьи делает ее очень информативным чтением.
Подробное сравнение этих двух пищеварительных ферментов увлекательно. Очень поучительное чтение.
Подробное описание обоих ферментов очень понятно и полезно!
Согласитесь, статья хорошо структурирована и понятна.
Да, отличный источник информации по этой теме.
Хорошо исследованное произведение. Спасибо, что поделился!
Спасибо за этот всесторонний взгляд на различия между химотрипсином и трипсином.