Гальванические или электролитические элементы являются одним из наиболее важных компонентов, крайне необходимых в полупроводниковой промышленности и за ее пределами.
Гальванические элементы используются в батареях, помогая нам питать приборы любого размера, тогда как электролитические элементы в основном используются для гальваники. Механизм и выход обеих клеток различны.
Основные выводы
- Гальванические элементы генерируют электрическую энергию посредством спонтанных окислительно-восстановительных реакций, в то время как электролитические элементы потребляют электрическую энергию для проведения неспонтанных реакций.
- В гальванических элементах анод является местом окисления, а катод — местом восстановления; в электролитических ячейках анод - это место, где происходит восстановление, а катод - место, где происходит окисление.
- Гальванические элементы обычно используются в батареях, тогда как электролитические элементы используются в таких процессах, как гальваника и электролиз.
Гальванические элементы против электролитических элементов
Гальванические элементы генерируют электрическую энергию в результате спонтанной окислительно-восстановительной реакции между двумя металлическими электродами, создавая поток электронов для производства электрической энергии. Электролитические элементы используют электрическую энергию для запуска неспонтанной окислительно-восстановительной реакции, производя металлы, очищая металлы и гальванизируя металлы.

Гальванические элементы также известны как электрохимические элементы, в которых происходит спонтанная реакция для производства электричества.
Гальванические элементы состоят из двух полуэлементов, помещенных в разные контейнеры и соединенных солью. мост или пористая перегородка.
Электролитические элементы можно описать как противоположность гальваническим элементам, поскольку они преобразуют электрическую энергию в химическую энергию.
В общих реакциях энергия Гиббса положительна, и поэтому в электролитической ячейке происходят неспонтанные окислительно-восстановительные реакции.
Сравнительная таблица
| Параметры сравнения | гальванические элементы | Электролитические ячейки |
|---|---|---|
| Определение | Гальванические элементы представляют собой электрохимические элементы, которые могут производить электричество. | Электролитические элементы также являются электрохимическими элементами, но они используют электрическую энергию для облегчения химических реакций. |
| Конверсия | Гальванические элементы преобразуют химическую энергию в электрическую. | Электролитические ячейки преобразуют электрическую энергию в химическую энергию. |
| реакция | В гальваническом элементе протекает самопроизвольная реакция. | В электролитических ячейках протекают несамопроизвольные окислительно-восстановительные реакции. |
| Тариф за | Отрицательный заряд находится на аноде, а положительный – на катоде. | Отрицательный заряд находится на катоде, а положительный заряд — на аноде. |
| Окисление | Процесс окисления происходит на аноде. | Окисление происходит на катоде. |
| размещение | Полуэлементы размещены в разных контейнерах и соединены солевым мостиком. | В раствор электролита электроды помещают в одну емкость. |
| Приложения | Используется в аккумуляторах. | В основном используется в гальванике, а также в очистке меди. |
Что такое гальванические элементы?
В гальваническом элементе окислительно-восстановительная реакция, вызывающая перенос электронов между частицами, протекает самопроизвольно. И это количество электрической работы совершается энергией Гиббса для спонтанной реакции.
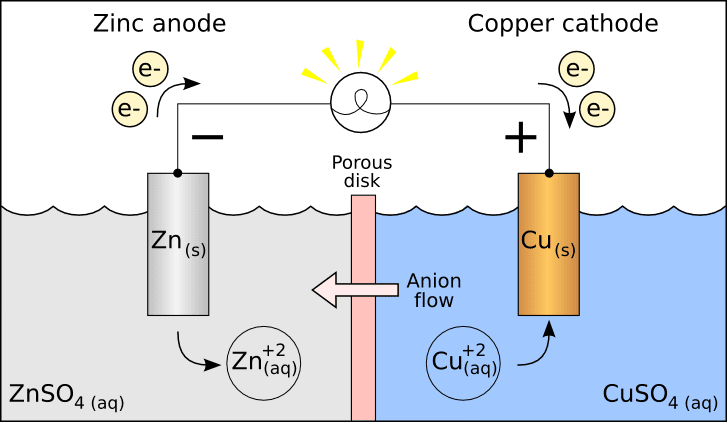
Две полуэлемента в гальваническом элементе хранятся отдельно в двух контейнерах и соединены соляным мостом. Металлические электроды, присутствующие в каждой полуэлементе, погружены в электролит. Решение.
Если электроды погружены в один и тот же электролит, солевой мостик не требуется.
В гальваническом элементе шесть частей: анод, катод, солевой мостик, полуэлементы, внешняя цепь и нагрузка.
В этой ячейке анод имеет отрицательный потенциал, а катод — положительный потенциал относительно раствора.
Итак, когда переключатель включен, из-за созданной разности потенциалов электроны начинают течь от анода к катоду.
Концепция гальвано-электрохимических элементов была введена для изучения термодинамических свойств расплавленных солей. Ниже приведена реакция ячейки Даниэля, типа гальванического элемента.
На катоде: Cu 2+ + 2e– → Cu (восстановлено)
На аноде: Zn → Zn2+ + 2e– (окисляется)
Гальванические элементы являются примером того, как простая реакция производит энергию, и эта энергия может быть использована для производства электричества. Эти элементы в основном используются в батареях.
Что такое электролитические ячейки?
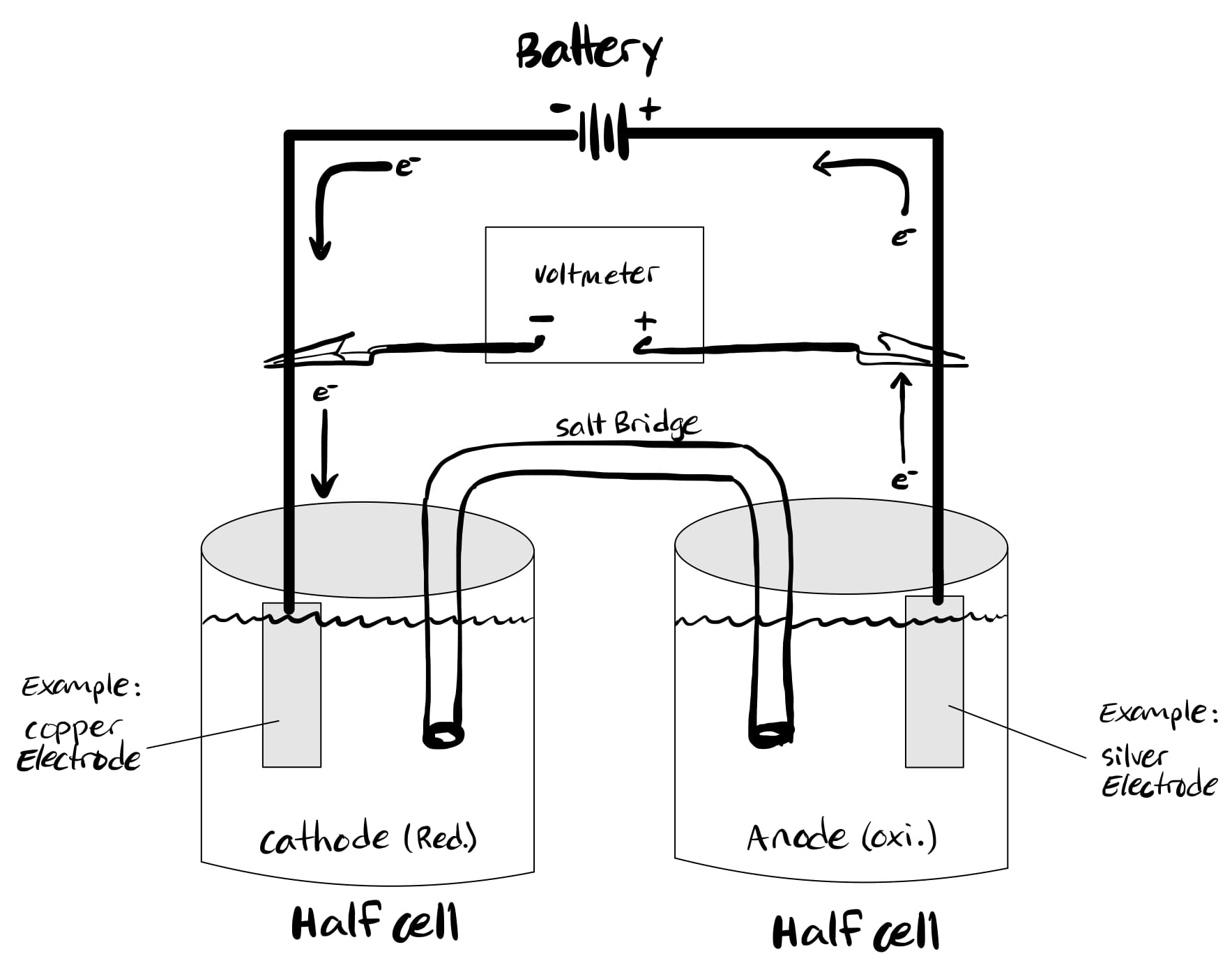
В то время как гальванические (гальванические) элементы управляются спонтанными химическими реакциями, электролитические элементы управляются неспонтанными окислительно-восстановительными реакциями.
Он преобразует электрическую энергию в химическую, в отличие от гальванических элементов. В электролитической ячейке, окисление происходит на катоде, а восстановление происходит на аноде.
Это иногда создает путаницу, потому что окисление происходит на аноде. Итак, легче запомнить, что в электролитической ячейке анод положительный, а катод отрицательный.
Общая энергия Гиббса положительна, поскольку реакции не являются самопроизвольными. Электролизеры можно использовать для электролиза определенных соединений, таких как вода.
Если воду подвергнуть электролизу с использованием электролитической ячейки, то будет происходить образование газообразных кислорода и водорода.
Механизм электролитической ячейки можно хорошо понять на примере расплавленного хлорида натрия (NaCl). Клеточные реакции приведены ниже.
На катоде: [Na+ + e– → Na] x 2 (восстановлено)
На аноде: 2Cl– → Cl2 + 2e– (окисляется)
Клеточная реакция: 2NaCl → 2Na + Cl2
Для проведения вышеуказанных реакций два электрода погружают в расплавленный NaCl, и когда электричество проходит по цепи, катод становится отрицательно заряженным.
Таким образом, ионы натрия (положительно заряженные) притягиваются к катоду и, таким образом, при восстановлении образуют металлический натрий.
Основные различия между гальваническими элементами и электролитическими элементами
- Гальванические элементы - это электрохимические элементы, которые могут производить электричество, тогда как электролитические элементы также являются электрохимическими элементами, но они используют электрическую энергию для облегчения химических реакций.
- Гальванические элементы преобразуют химическую энергию в электрическую, тогда как электролитические элементы преобразуют электрическую энергию в химическую.
- В гальваническом элементе протекает самопроизвольная реакция, тогда как в электролитических элементах происходят несамопроизвольные окислительно-восстановительные реакции.
- В гальваническом элементе отрицательный заряд находится на аноде, а положительный — на катоде, тогда как в электролитическом элементе все наоборот.
- В гальваническом элементе процесс окисления происходит на аноде, а в электролитическом элементе - на катоде.
- В гальваническом элементе полуэлементы помещены в разные контейнеры, тогда как в электролитических элементах электроды находятся в одном контейнере.
- https://avesis.marmara.edu.tr/yayin/17177586-0673-4859-9b7c-66eafdae92d7/prospective-teachers-conceptual-understanding-of-electrochemistry-galvanic-and-electrolytic-cells
- https://onlinelibrary.wiley.com/doi/abs/10.1002/(SICI)1098-2736(199704)34:4%3C377::AID-TEA7%3E3.0.CO;2-O
Последнее обновление: 30 июня 2023 г.

Пиюш Ядав последние 25 лет работал физиком в местном сообществе. Он физик, увлеченный тем, чтобы сделать науку более доступной для наших читателей. Он имеет степень бакалавра естественных наук и диплом о высшем образовании в области наук об окружающей среде. Подробнее о нем можно прочитать на его био страница.


Отличная статья, очень четко объясняющая различия между гальваническими и электролитическими элементами и их различными применениями. Очень помогли реакция клетки Даниила и пример расплавленного хлорида натрия. Очень подробное и подробное объяснение.
В этой статье проводится хорошее сравнение гальванических и электролитических элементов. Однако, похоже, автор слишком волен в техническом плане. Это можно было бы понять проще.
Не согласен. Если вы пытаетесь изучить такой сложный предмет, вы должны быть готовы иметь дело с техническими терминами и понятиями.
Я вас понимаю. Это очень много информации, которую нужно потреблять за один раз.
Очень интересно читать, как работают эти клетки и их различные применения. Отличные примеры, которые легко понять тем, кто имеет научное образование.
Примеры были определенно лучшей частью. Они значительно облегчили восприятие информации.
Это очень информативно, но объяснение слишком техническое и может быть трудным для понимания широкой публики.
Используемая терминология очень сложна, и для ее глубокого понимания могут потребоваться некоторые предварительные знания в области науки или техники.
Писатель хорошо объяснил два типа клеток. Также я рад, что этот текст не находится в учебниках.
Это было бы невероятно сложно понять ученику средней школы. Это должно быть опубликовано для студентов-инженеров или ученых.
В этом я согласен с Лорен. Это скорее материал научного курса продвинутого уровня.
Это очень информативная статья, я прочитал несколько статей, но нашел ее очень подробной, охватывающей все основные основы и многое другое. Именно то, что я искал.