Две врсте реакција су описане речима ендергониц и екергониц. Многе хемијске и биолошке интеракције се непрестано дешавају унутар и изван људског тела.
Овај чланак користи дескриптивну табелу да разликује основне и напредне разлике између две реакције ради лакшег учења и разумевања од стране почетника, као и ентузијаста хемикалија.
Кључне Такеаваис
- Ексергонске реакције ослобађају енергију, док ендергонске реакције апсорбују енергију из свог окружења.
- Ексергонске реакције имају негативну Гибсову промену слободне енергије, док ендергонске реакције имају позитивну.
- Ендергонске реакције су неспонтане, док су ексергонске реакције спонтане под датим условима.
Ексергоничне реакције против Ендергоничких реакција
Екергониц реакције су хемијске реакције у којима је промена слободне енергије негативна, или постоји нето ослобађање слободне енергије и указује на спонтану реакцију. Ендергонске реакције су реакције у којима је стандардна промена слободне енергије позитивна, а за то је потребна покретачка сила.

Реакција која генерише слободну енергију позната је као 'ексергонска' реакција. Пошто ова реакција производи енергију, а не троши је, може се десити сама, без интервенције других сила.
Ексергонске реакције у биохемији, као и термохемији, су оне код којих је промена слободне енергије негативна (минус у бројчаној вредности).
То нису нехотичне реакције које су спонтане. За почетак, потребан им је напор или унос силе – углавном у облику енергије.
Уобичајена улога ендергонске реакције је ослобађање енергије из молекула угљених хидрата или било ког наводног молекула хране, омогућавајући створењима да напредују без ослањања искључиво на сунчеву светлост за енергију.
Упоредна табела
| Параметри поређења | Екергониц Реацтионс | Ендергонске реакције |
|---|---|---|
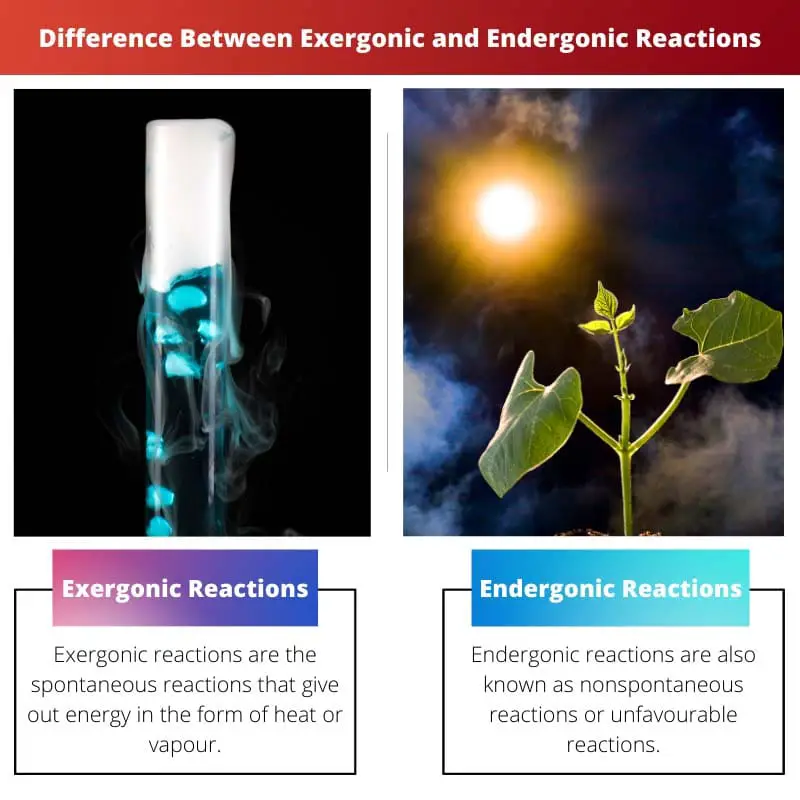
| Дефиниција | Ексергонске реакције су спонтане реакције које дају енергију у облику топлоте или паре. | Ендергонске реакције су такође познате као неспонтане реакције или неповољне реакције. Реакција захтева више енергије него што добијате |
| Гиббс Фрее Енерги | Вредност Гибсове слободне енергије је негативна. | Вредност Гиббсове слободне енергије је позитивна. |
| Ентропијски ниво | Ниво ентропије је повећан у типичној ексергонској реакцији. | Ентропија се смањује у ендергонској реакцији. |
| Енерги Рекуиремент | Даје енергију у облику топлоте. | Уноси енергију кроз околину за покретање или наставак реакције. |
| Примери | Реакција натријума и хлора за стварање кухињске соли, сагоревање и хемилуминисценција. У овој реакцији енергија се ослобађа у облику светлости. | Хемијска реакција фотосинтезе је добар пример за ендергонске реакције. |
Шта су ексергонске реакције?
Ексергоничне су неповратне реакције које се природно јављају у окружењу. Израз „спонтано“ односи се на нешто спремно или жељно да се догоди са мало или без спољне стимулације.
Када је изложен кисеонику у атмосфери, натријум ће, на пример, сагорети. Још један пример ексергоничних реакција је пушење дрвета.
Под стандардном температуром и притиском, Гибсова слободна енергија је нула, што указује да се више топлоте узима него апсорбује. То су одговори који се не могу преокренути.
Живи организми користе ексергонске процесе за транспорт енергије из „складишта“ у једној компоненти, као што су маст или шећер, у активирано стање, као што је АТП.
Шта су ендергонске реакције?
Процес у којем се апсорбује топлота или било који облик енергије познат је као ендергонска реакција. То значи да је укупна промена слободне енергије позитивна у хемијском смислу.
Многи процеси у природи могу се одвијати само ако је доступна адекватна енергија из околине.
Спољашња енергетска помоћ у распуштање ових веза. Енергија која се ослобађа као резултат прекида везе тада подстиче реакцију.
У случају ендергоничних реакција, ова Гибсова слободна енергија је позитивна (+), што указује да реакција није спонтана.
Главне разлике између ексергоничких и ендергонијских реакција
- Код ексергоничких реакција ентропија расте, док се код ендергоничких ентропија смањује.
- Енергија производа ексергонске реакције је већа од реактаната, док је енергија производа мања од реактаната у случају ендергонијских реакција.
- https://www.khanacademy.org/science/biology/energy-and-enzymes/free-energy-tutorial/a/gibbs-free-energy
- https://bio.libretexts.org/Bookshelves/Introductory_and_General_Biology/Book%3A_General_Biology_(Boundless)/6%3A_Metabolism/6.2%3A_Potential_Kinetic_Free_and_Activation_Energy/6.2A%3A__Free_Energy
Последње ажурирање: 07. септембар 2023

Пијуш Јадав је последњих 25 година провео радећи као физичар у локалној заједници. Он је физичар који страствено жели да науку учини доступнијом нашим читаоцима. Дипломирао је природне науке и постдипломске студије заштите животне средине. Више о њему можете прочитати на његовом био паге.


Овај чланак представља детаљну анализу ексергоничких и ендергонијских реакција, расветљавајући њихов значај у хемијским и биолошким интеракцијама.
Овај чланак пружа проницљиво и свеобухватно објашњење ексергоничких и ендергонијских реакција. Табела поређења и примери су посебно корисни у разумевању кључних разлика.
Чланак је веома информативан и добро структуриран. Јасна разлика између ексергоничких и ендергонијских реакција олакшава читаоцима да схвате концепте.
Разјашњење ексергоничких и ендергоничких реакција у чланку је за похвалу, нудећи читаоцима стручно разумевање хемијских и биолошких процеса којима управљају.
У чланку се вешто објашњава дихотомија између ексергонијских и ендергонијских реакција, илуструјући њихове импликације у различитим природним феноменима.
Објашњење ексергонијских и ендергонијских реакција у чланку је врло артикулисано и поучно. Наведени примери из стварног живота служе као практичне илустрације, доприносећи бољем разумевању концепта.
Свеобухватно поређење између ексергоничких и ендергоничких реакција је за похвалу, разјашњавајући кључне диспаритете са прецизношћу и јасноћом.
Детаљна упоредна табела ефективно наглашава фундаменталне диспаритете између ексергоничких и ендергоничких реакција, служећи читаоцима са различитим нивоима стручности. Употреба описних примера додатно побољшава разумевање.