الجدول الدوري للكيمياء هو شيء يُطلب من الطلاب حفظه بشكل مضجر دون معرفة الدافع الفعلي وراء تعلمه. بالنسبة لبعض الأشخاص ، إنه مجرد موضوع مدرج في منهجهم الدراسي.
ولكن بالمعنى الحقيقي ، فإن هذا الجدول الدوري الصغير هو أكثر أهمية من ذلك بكثير ؛ إنها خارطة طريق تفتح مليون فرصة للعلماء والباحثين في جميع أنحاء العالم. ديمتري مندلييف هو مخترع الجدول الدوري.
قبله ، حاول الكثيرون جاهدين ترتيب العناصر الكيميائية بطرق مختلفة. لكن النتيجة التي توصل إليها دميتري كانت مقبولة في جميع أنحاء العالم.
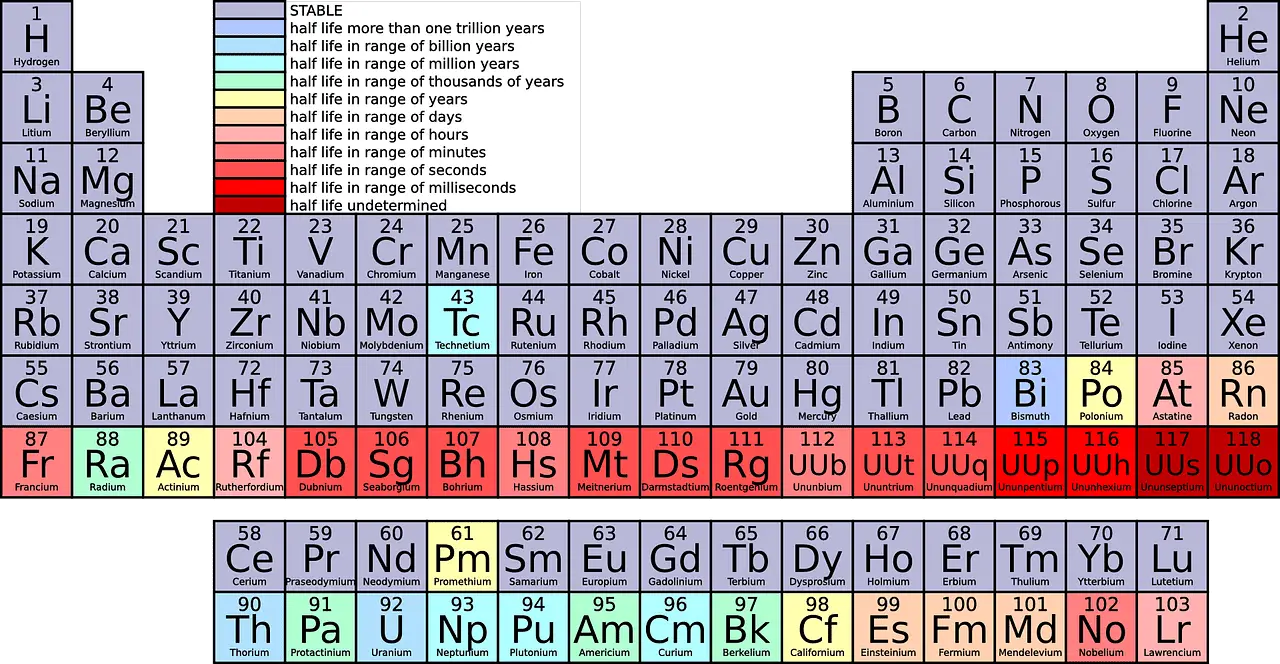
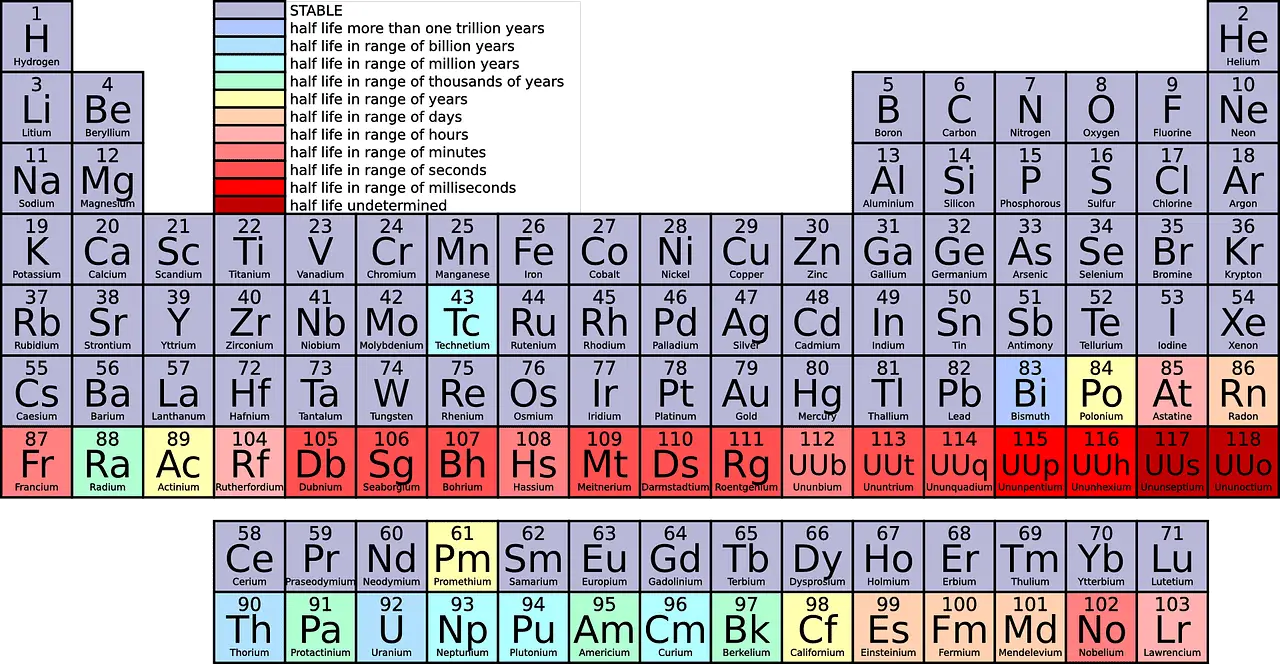
في الاختصارات العلمية ، يشار إلى الصفوف بالفترات والأعمدة كمجموعات ، على التوالي.
الوجبات السريعة الرئيسية
- الفترات هي الصفوف الأفقية في الجدول الدوري ، والتي تشير إلى عدد قذائف الإلكترون في ذرات العنصر ، مع وجود عناصر في نفس الفترة لها هياكل ذرية متشابهة.
- المجموعات هي الأعمدة الرأسية في الجدول الدوري ، وتتكون من عناصر لها نفس عدد الإلكترونات في غلافها الخارجي ، مما يؤدي إلى خصائص كيميائية متشابهة.
- تنظم كل من الفترات والمجموعات العناصر في الجدول الدوري ، مع فترات تمثل الصفوف الأفقية بناءً على غلاف الإلكترون والمجموعات التي تمثل الأعمدة الرأسية بناءً على إلكترونات الغلاف الخارجي والخصائص الكيميائية.
الفترة مقابل المجموعة
الفترة هي صف أفقي يمتد من الجانب الأيسر إلى الجانب الأيمن من الجدول الدوري ، وتزداد الكهربية عبره. المجموعة هي عمودي عمود الذي ينتقل من أعلى الجدول الدوري إلى أسفله ، وتزداد الطاقة الكهربية من أسفل إلى أعلى.

خلال وقت الترتيب ، ترك Mendeleyev بضعة صفوف فارغة مع انطباع بأن بعض العناصر الأخرى ستدخل في المستقبل القريب. والمثير للدهشة أن أحد العناصر التي تم تركيبها في تلك الفجوة كان الغاليوم عنصر فلزي نادر.
جدول المقارنة
| معلمة المقارنة | فترة | تجمع |
|---|---|---|
| طريقة الاستخدام: | الفترات هي الصفوف الأفقية في الجدول الدوري الحديث | المجموعات هي الأعمدة الرأسية التي تمر عبر الجزء العلوي من الجدول الدوري |
| عقارات | العناصر في فترة ما ليس لها خصائص مماثلة. | العناصر في كل مجموعة لها بعض الخصائص المتشابهة ولكن ليس لها خصائص متطابقة. |
| تشابه | العناصر في نفس الفترة لها عدد متساوٍ من تكوين الإلكترون | العناصر في كل مجموعة لها عدد متساوٍ من إلكترونات التكافؤ |
| مجموع | هناك 7 فترات في الجدول الدوري | تحتوي المجموعة على 18 عنصرًا مرتبة رأسياً في الجدول الدوري الحديث. |
| كهرسلبية | يزداد من اليسار إلى اليمين. | يزيد من أسفل إلى أعلى في مجموعة. |
ما هي فترة؟
النقطة هي صف أفقي من أقصى اليسار إلى أقصى اليمين في الجدول الدوري. اعتبارًا من الآن ، هناك 7 فترات في الجدول الدوري.
تبدأ فترة جديدة عندما يتراكم مستوى طاقة أساسي جديد مع الإلكترونات. من المحتمل أن يكون لكل عنصر في فترة ما عدد متساوٍ من المدارات الذرية.
على سبيل المثال - كل عنصر في 1st الفترة لها 1 فقط مداري لإلكتروناتها ، 2nd تشمل الفترة مداريين للإلكترونات. وبالمثل ، تستمر المدارات في الجمع كلما تحركت لأسفل في الصف.
يتناقص حجم العنصر كلما تحركت عبر فترة ما حيث يظل عدد قذائف الإلكترون ثابتًا ، لكن عدد البروتونات يرتفع في النواة. هذا هو سبب زيادة وزن الذرة ، لكن الحجم يتناقص باستمرار.
بالنظر إلى الجدول الدوري ، سترى عناصر مختلفة مثبتة في كل صف. تحتوي الفترة الأولى على عنصرين فقط (1 و 2) ، والفترتان الثانية والثالثة بها 1 عناصر لكل منهما ، والفترتان الرابعة والخامسة تحتويان على 18 عنصرًا ، والفترتان السادسة والسابعة تحتويان على 2 عنصرًا لكل منهما ، على التوالي.
ما هي المجموعة؟
العد من أعلى إلى أسفل ، هناك 18 مجموعة في الجدول الدوري. يتم تخصيص أسماء مميزة لجميع المجموعات.
المجموعات عبارة عن فئات مختلطة من المعادن ، واللافلزات ، وشبه الفلزات ، مجمعة في عائلات وفقًا لخصائصها المتشابهة. على سبيل المثال ، تنتمي المجموعة 1 إلى عائلة الليثيوم ، المصنفة على أنها معادن ألكينية.
وبالمثل ، فإن كل مجموعة في المسار لها اسمها العائلي. العناصر في المجموعة ذات الصلة لها سمات متشابهة لأن لها نفس عدد الإلكترونات في غلافها الخارجي.
يزداد حجم العنصر كلما تحركت أي مجموعة لأسفل. هذا بسبب وجود أعداد كبيرة من البروتونات والنيوترونات في النواة.
علاوة على ذلك ، فإن غلاف الإلكترون الإضافي يجعل الذرة أثقل. بالنسبة للمجموعات ، هناك طريقتان مختلفتان لتوضيح العناصر.
يعد فهم نظامي الترقيم أمرًا ضروريًا لأن الجدول الدوري يظهر في كلا التنسيقين. في الولايات المتحدة ، استخدموا الحروف A & B للإشارة إلى كل عنصر في المجموعة ، ولكن لسوء الحظ ، لوحظ أنه نظام ترقيم غير منظم.
للقضاء على كل الارتباك المحتمل ، الأممية الاتحاد في الكيمياء البحتة والتطبيقية (IUPAC) جاءت فكرة ترقيم العناصر كـ (1,2 ، 3 ، 18 ... XNUMX). ومع ذلك ، فإن كلا نظامي الترقيم مقبولان. لكن ترقيم IUPAC يبدو منظمًا جيدًا ومباشرًا.
الاختلافات الرئيسية بين الفترة والمجموعة
- اﻟﻌﻨﻮان المجموعات هي العمود الرأسي ، بينما الفترات هي الصفوف المستقيمة في الجدول الدوري.
- عدد: هناك إجمالي 18 عددًا من المجموعات و 7 فترات في الجدول الدوري ، من بينها المجموعات التي يتم تصنيفها تحت فئات مختلفة من العائلات وأنواع المعادن.
- الخواص الكيميائية: جميع العناصر في المجموعة لها خصائص كيميائية أو فيزيائية مماثلة ، بينما تشترك الفترات في نفس التسلسل الهرمي للإلكترون.
- مستوى الطاقة: عندما ننزل المجموعة من أعلى إلى أسفل ، يزداد مستوى طاقة الإلكترونات. من ناحية أخرى ، في كل فترة ، يظل مستوى طاقة الإلكترون كما هو.
- كهرسلبية: هذا ينخفض من أعلى إلى أسفل في مجموعة ويرتفع من اليسار إلى اليمين في فترة. هذا اعتبار أساسي أثناء دراسة الجدول الدوري.

آخر تحديث: 11 يونيو 2023

أمضى بيوش ياداف السنوات الخمس والعشرين الماضية في العمل كفيزيائي في المجتمع المحلي. إنه فيزيائي شغوف بجعل العلم في متناول قرائنا. وهو حاصل على بكالوريوس في العلوم الطبيعية ودبلوم دراسات عليا في علوم البيئة. يمكنك قراءة المزيد عنه على موقعه صفحة بيو.

مقال عظيم! وهذا يعطي فكرة عظيمة عن أهمية الجدول الدوري. استمتعت بها حقا!
أنا سعيد للغاية لأنك وجدت أنه من المفيد. فعلت أيضا!
بالتأكيد، يجب على كل طالب علم أن يقرأ هذا.
وظيفة مفيدة للغاية. وعلينا أن ندفع من أجل تعليم أفضل وفهم أفضل للموضوعات العلمية.
هذا هو بالضبط ما نحتاج إليه.
وهذا مجرد مثال آخر للمعايير التعليمية التي عفا عليها الزمن. يجب أن نقوم بتدريس مواضيع أكثر صلة للطلاب.
أعتقد أنه من الأهمية بمكان أن يفهم الطلاب الجدول الدوري.
هذا أمر مثير للجدل يا جويل.
أعتقد أن الناس يقللون من قيمة الجدول الدوري. وينبغي لنا أن نفعل المزيد لتعزيز تدريسنا لها.
بالتأكيد، هذه نقطة مهمة.
أعتقد أنه من المثير للاهتمام حقًا أن مثل هذا الجدول الذي يبدو بسيطًا يمكن أن يحتوي على الكثير من المعلومات القيمة.
نعم، انها رائعة جدا.
هذا مفيد. تم التقليل من شأن الجدول الدوري.
لقد كانت هذه قراءة مطلوبة بشدة لبدء يومي!
بعض النقاط الصحيحة المعروضة هنا، لكنني ما زلت غير مقتنع بأهمية الجدول الدوري.
وأنا أتفق معك، زاك.
يعد الجدول الدوري حجر الزاوية في الكيمياء ويجب التعامل معه على هذا النحو.
لا يمكن اقبل المزيد.
لا أوافق على ذلك، أعتقد أن تدريس الجدول الدوري بالطريقة الحالية أمر قديم ويجب مراجعته.
أستطيع أن أرى لماذا قد يجدها البعض قديمة، ولكنها في الحقيقة أمر حيوي للتطور العلمي.
أستطيع أن أرى ما تقوله ولكني لا أتفق معك تماماً.
على الرغم من أنني أفهم أهمية الجدول الدوري، إلا أنه من الصعب القول بأن النظام التعليمي الحالي مناسب.
لقد أثرت نقطة مهمة يا إيرين.