Le monde est un bel endroit. Les montagnes, la mer, le ciel et toutes les choses qui existent physiquement comprennent des atomes.
Ce sont les blocs de construction de l'univers. Cependant, les atomes ne sont pas stables. Par conséquent, ils se stabilisent en fabriquant des molécules et des ions.
Faits marquants
- Une molécule est un groupe de deux ou plusieurs atomes chimiquement liés ensemble, tandis qu'un ion est un atome ou une molécule avec une charge électrique.
- Les molécules sont neutres, tandis que les ions peuvent être chargés positivement ou négativement.
- Les molécules sont formées par liaison covalente, tandis que les ions sont formés par le transfert d'électrons entre les atomes.
Molécule vs Ion
Les molécules et les ions diffèrent car une molécule n'a pas de charge nette, contrairement à un ion. Cela se produit parce que tout dans cet univers veut atteindre l'équilibre.
Les atomes le font en formant des molécules et des ions. De plus, les molécules se développent en partageant des électrons, tandis que les ions se forment en raison de l'échange d'électrons.
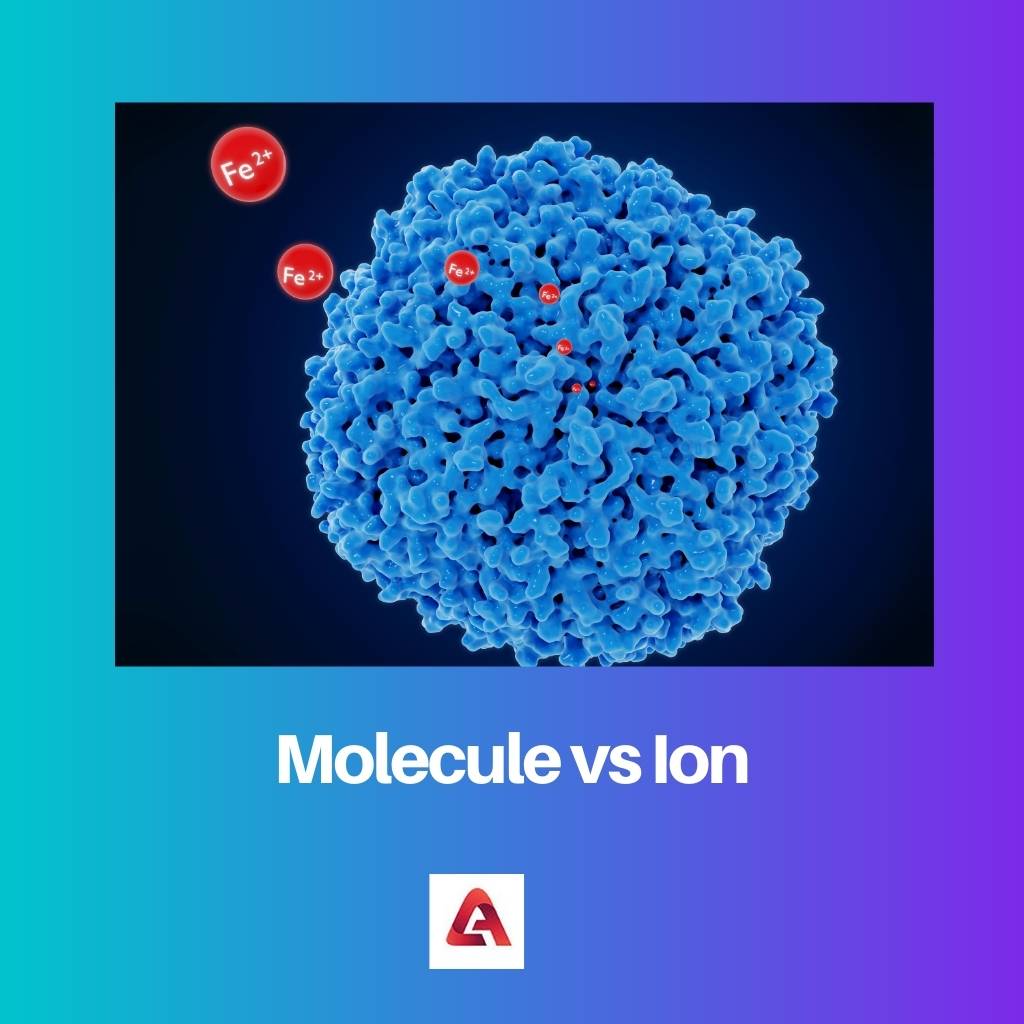
Un ou plusieurs atomes forment des liaisons covalentes pour devenir une molécule. La plus petite unité dont une substance est faite est une molécule. Une molécule conserve toutes les propriétés chimiques de l'essence. Les atomes représentent des molécules, représentées à l'aide de cercles, formant des liaisons ensemble.
Une espèce chimique avec une charge nette positive ou négative est connue sous le nom d'ion. Un atome et une molécule peut être qualifiée d'ion si elle a des comptes nets non nuls. Par conséquent, tous les ions ont soit plus d'électrons que de protons, soit plus de protons que d'électrons dans leur structure moléculaire ou atomique.
Tableau de comparaison
| Paramètres de comparaison | Molécule | ion |
|---|---|---|
| Répartition des électrons | Les molécules sont formées en raison du partage d'électrons entre deux atomes ou plus ou par deux ions chargés de manière opposée. | Les ions se forment lorsque les atomes gagnent ou perdent de la charge pour obtenir une configuration de gaz rare. |
| Taille | La taille des molécules dépend de la taille des atomes ou des ions impliqués dans la formation de la liaison. | Les anions sont plus importants que les molécules mères et les cations sont plus mineurs que les molécules mères. |
| Stabilité | Les molécules sont plus stables que les ions. | Les ions sont moins stables que les molécules. |
| Formation | Les liaisons covalentes ou les liaisons ioniques forment des molécules. | Les ions sont formés par liaison ionique entre deux ions de charge opposée et sont plus puissants que covalents. |
| Conduction de l'électricité | Puisque les molécules ont des charges nettes nulles, elles ne sont pas de bons conducteurs d'électricité. | Les ions sont de bons conducteurs d'électricité. |
Qu'est-ce qu'une Molécule ?
La plus petite unité d'un composé, qui montre les propriétés chimiques du composé, est connue sous le nom de molécule. Les molécules sont constituées de deux atomes ou plus liés ensemble de manière covalente, c'est-à-dire qu'elles partagent un ou plusieurs électrons.
Les molécules constituent la majeure partie de la terre et presque toutes les substances organiques sont constituées de molécules.
Les molécules peuvent être homonucléaires et hétéronucléaires, ce qui signifie qu'elles comprennent respectivement les mêmes éléments ou des éléments différents.
Une liaison covalente se forme lorsque deux atomes avec des octets incomplets partagent des bits. Une liaison covalente transforme les différents atomes en une molécule.
Les molécules sont constituées d'atomes regroupés soit par des liaisons covalentes, soit par des liaisons ioniques.
Les molécules liées par covalence sont plus faibles que les molécules liées ioniques. Cela se produit parce que les liaisons ioniques ont une puissante force électrostatique qui maintient les ions ensemble.
De ce fait, les molécules ioniques sont plus stables que les molécules liées par covalence.

Qu'est-ce qu'un Ion ?
Un ion est une espèce chimique avec une charge nette positive ou négative d'une certaine ampleur. Les ions font référence aux molécules et aux atomes qui ont un contrôle net non nul.
Par conséquent, les ions ont soit plus de protons que d'électrons, soit plus d'électrons que de protons dans leur structure moléculaire ou atomique.
Les ions qui ont un nombre d'électrons plus important que les protons et qui détiennent une charge nette négative sont appelés anions.
Inversement, les ions avec un nombre plus important de protons que d'électrons et détenant une charge positive nette sont appelés cations.
Les liaisons ioniques ne se forment que lorsque des forces électrostatiques apparaissent entre un anion chargé négativement et un cation chargé positivement.
Ces forces électrostatiques attirent les anions et les cations les uns vers les autres pour stabiliser la charge nette. Ces forces électrostatiques contribuent à la formation de composés ioniques.
Les ions constitués d'un seul élément sont appelés ions atomiques ou monoatomiques. Les atomes participants détiennent une certaine charge nette, positive ou négative.
Alors que si deux éléments ou plus sont impliqués dans un ion, ils sont appelés ions moléculaires ou polyatomiques.
Principales différences entre les molécules et les ions
- Les molécules n'ont pas de charge nette, alors que les ions ont un contrôle net positif ou négatif.
- Les molécules se forment lorsque deux ou plusieurs atomes partagent des électrons pour compléter leur octet, tandis que les ions échangent des électrons et forment composés ioniques due aux forces électrostatiques.
- Étant donné que les ions sont maintenus ensemble par des forces électrostatiques, ils sont beaucoup plus stables que les molécules formées par des liaisons covalentes.
- En raison des forces d'attraction élevées entre deux ions, ils ont plus d'énergie de réseau que les molécules liées par covalence.
- En raison de l'énergie de réseau plus élevée, les ions sont plus stables que liés par covalence.
- La taille des molécules dépend des atomes impliqués dans les formations de liaisons. Les cations sont plus petits que leurs molécules mères, tandis que les anions sont plus importants que leurs molécules mères.

- https://ui.adsabs.harvard.edu/abs/1988STIA…8915174M/abstract
- https://pubs.acs.org/doi/pdf/10.1021/ja00260a006
Dernière mise à jour : 11 juin 2023

Piyush Yadav a passé les 25 dernières années à travailler comme physicien dans la communauté locale. C'est un physicien passionné par l'idée de rendre la science plus accessible à nos lecteurs. Il est titulaire d'un baccalauréat en sciences naturelles et d'un diplôme d'études supérieures en sciences de l'environnement. Vous pouvez en savoir plus sur lui sur son page bio.


Le tableau comparatif de l’article s’est avéré particulièrement utile pour comprendre les caractéristiques distinctes des molécules et des ions. C'est un excellent point de référence pour des comparaisons rapides.
J'ai également trouvé les comparaisons très utiles. C'est un moyen pratique de saisir rapidement les principales disparités entre les molécules et les ions.
L’article proposait une comparaison complète des molécules et des ions, mais il lui manquait une approche plus engageante pour rendre le contenu plus captivant pour les lecteurs.
Je vois ce que tu veux dire. Même si les informations étaient précieuses, un récit plus engageant aurait pu renforcer l’attrait général de l’article.
Le tableau comparatif de l’article résume efficacement les principales différences entre les molécules et les ions. C'est un outil utile pour revoir et renforcer les concepts.
L'article fournit une compréhension claire et concise des molécules et des ions, ce qui est précieux pour les débutants dans le domaine de la chimie.
Je suis d'accord. C'est un bon point de départ pour quiconque débute en chimie, mais il aurait pu inclure des concepts plus avancés pour ceux qui ont une compréhension plus approfondie du sujet.
Cet article est un regard fascinant sur le monde des molécules et des ions. Les explications détaillées et les comparaisons ont fourni d’excellentes informations.
J'ai trouvé l'article très instructif et bien structuré. Cela m'a vraiment aidé à comprendre les différences entre les molécules et les ions.
Je suis complètement d'accord. Les informations fournies sont très pédagogiques et intéressantes.
L’article a fait un bon travail en simplifiant des concepts complexes, mais il manquait des discussions approfondies sur les propriétés chimiques et les comportements des molécules et des ions.
Je suis d'accord avec toi. Bien que l’article fournisse un aperçu général, il aurait pu inclure des informations plus détaillées sur les propriétés chimiques de ces unités fondamentales.
Les comparaisons fournies ont été très utiles pour comprendre les différences entre les molécules et les ions. J'apprécie la clarté des explications.
J'ai trouvé l'article un peu trop élémentaire. Il n’offrait pas beaucoup de profondeur à ceux qui recherchaient des informations plus avancées.
Je ne pourrais pas être plus d'accord. La clarté et la simplicité de l'article en font une ressource précieuse pour toute personne intéressée par la chimie.
Je pense que l'article met efficacement en évidence les principales différences entre les molécules et les ions, ce qui le rend plus facile à comprendre pour les experts non-chimistes.
Je pense que l'article a simplifié à l'extrême les concepts de molécules et d'ions. Il aurait pu approfondir la chimie derrière ces éléments fondamentaux.
Je comprends votre point de vue, mais pour un aperçu général, l'article constitue un bon point de départ. Il est important de rendre les sujets complexes accessibles à un large public.
Les explications étaient claires et concises, permettant de mieux comprendre les différences entre les molécules et les ions. L’article a fourni une base solide pour un apprentissage ultérieur.
J'ai également trouvé la clarté des explications très utiles. C’est idéal pour acquérir une solide compréhension de ces concepts.