Galvaniskās vai elektrolītiskās šūnas ir viena no vissvarīgākajām sastāvdaļām, kas ir ļoti nepieciešamas pusvadītāju rūpniecībā un ne tikai.
Galvaniskās šūnas tiek izmantotas baterijās, palīdzot mums darbināt jebkura izmēra ierīces, savukārt elektrolītiskās šūnas galvenokārt tiek izmantotas galvanizācijai. Abu šūnu mehānisms un izvade ir atšķirīgi.
Atslēgas
- Galvaniskās šūnas ģenerē elektrisko enerģiju spontānās redoksreakcijās, savukārt elektrolītiskās šūnas patērē elektrisko enerģiju, lai vadītu ne-spontānas reakcijas.
- Galvaniskajās šūnās anods ir oksidācijas vieta, bet katods ir reducēšanas vieta; elektrolītiskajās šūnās anods ir vieta, kur notiek reducēšana, un katods ir vieta, kur notiek oksidēšanās.
- Galvaniskās šūnas parasti izmanto baterijās, savukārt elektrolītiskās šūnas izmanto tādos procesos kā galvanizācija un elektrolīze.
Galvaniskās šūnas pret elektrolītiskajām šūnām
Galvaniskās šūnas ģenerē elektrisko enerģiju no spontānas redoksreakcijas starp diviem metāla elektrodiem, radot elektronu plūsmu elektroenerģijas ražošanai. Elektrolītiskās šūnas izmanto elektrisko enerģiju, lai vadītu ne-spontānu redoksreakciju, ražojot metālus, attīrot metālus un elektroplākšņu metālus.

Galvaniskās šūnas ir pazīstamas arī kā elektroķīmiskās šūnas, kurās notiek spontāna reakcija, lai ražotu elektroenerģiju.
Galvaniskās šūnas sastāv no divām puselementiem, kas ir ievietoti dažādos konteineros un ir savienoti ar sāli tilts vai poraina starpsiena.
Elektrolītiskos elementus var raksturot kā pretstatu galvaniskajiem elementiem, jo tie pārvērš elektrisko enerģiju ķīmiskajā enerģijā.
Kopējās reakcijās Gibsa enerģija ir pozitīva, un tādējādi elektrolītiskajā šūnā notiek ne-spontānas redoksreakcijas.
Salīdzināšanas tabula
| Salīdzināšanas parametri | Galvaniskās šūnas | Elektrolītiskās šūnas |
|---|---|---|
| Definīcija | Galvaniskās šūnas ir elektroķīmiskas šūnas, kas var ražot elektrību. | Elektrolītiskās šūnas ir arī elektroķīmiskās šūnas, taču tās izmanto elektrisko enerģiju, lai veicinātu ķīmiskās reakcijas. |
| Konversija | Galvaniskās šūnas pārvērš ķīmisko enerģiju elektroenerģijā. | Elektrolītiskās šūnas pārvērš elektrisko enerģiju ķīmiskajā enerģijā. |
| Reakcija | Galvaniskajā šūnā notiek spontāna reakcija. | Elektrolītiskajās šūnās notiek ne-spontānas redoksreakcijas. |
| Maksa | Negatīvais lādiņš atrodas pie anoda, bet pozitīvais lādiņš atrodas pie katoda. | Negatīvais lādiņš atrodas pie katoda, bet pozitīvais lādiņš atrodas pie anoda. |
| oksidācija | Oksidācijas process notiek pie anoda. | Oksidācija notiek pie katoda. |
| Izvietošana | Puse šūnas tiek ievietotas dažādos konteineros un savienotas ar sāls tilta palīdzību. | Elektrolīta šķīdumā elektrodus ievieto tajā pašā traukā. |
| Aplikācijas | Izmanto baterijās. | Pārsvarā izmanto galvanizēšanā un arī vara attīrīšanā. |
Kas ir galvaniskās šūnas?
Galvaniskajā šūnā redoksreakcija, kas izraisa elektronu pārnesi starp sugām, ir spontāna. Un šo elektriskā darba apjomu spontānai reakcijai veic Gibsa enerģija.
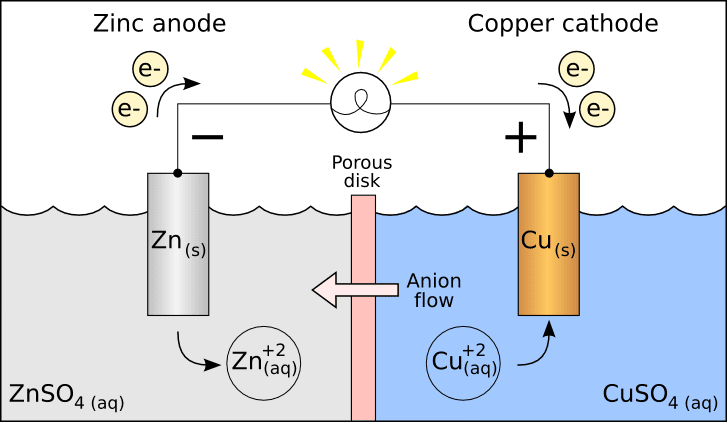
Divas puselementus galvaniskajā elementā glabā atsevišķi divos traukos un savieno ar sāls tiltiņu. Katrā puselementā esošie metāliskie elektrodi ir iegremdēti elektrolītā šķīdums.
Ja elektrodi ir iegremdēti vienā elektrolītā, sāls tiltam nav prasības.
Galvaniskajā elementā ir sešas daļas, proti, anods, katods, sāls tilts, puselementi, ārējā ķēde un slodze.
Šajā šūnā anodam ir negatīvs potenciāls un katodam ir pozitīvs potenciāls, gan attiecībā uz risinājumu.
Tātad, kad slēdzis ir ieslēgts, potenciālu starpības dēļ izveidotie elektroni sāk plūst no anoda uz katodu.
Galvanisko/elektroķīmisko elementu jēdziens tika ieviests, lai pētītu kausēto sāļu termodinamiskās īpašības. Zemāk ir parādīta Daniela šūnas, galvaniskās šūnas veida, reakcija.
Katodā: Cu 2+ + 2e– → Cu (reducēts)
Pie anoda: Zn → Zn2+ + 2e– (oksidēts)
Galvaniskās šūnas ir piemērs tam, kā vienkārša reakcija rada enerģiju un šo enerģiju var izmantot elektroenerģijas ražošanai. Šīs šūnas galvenokārt izmanto baterijās.
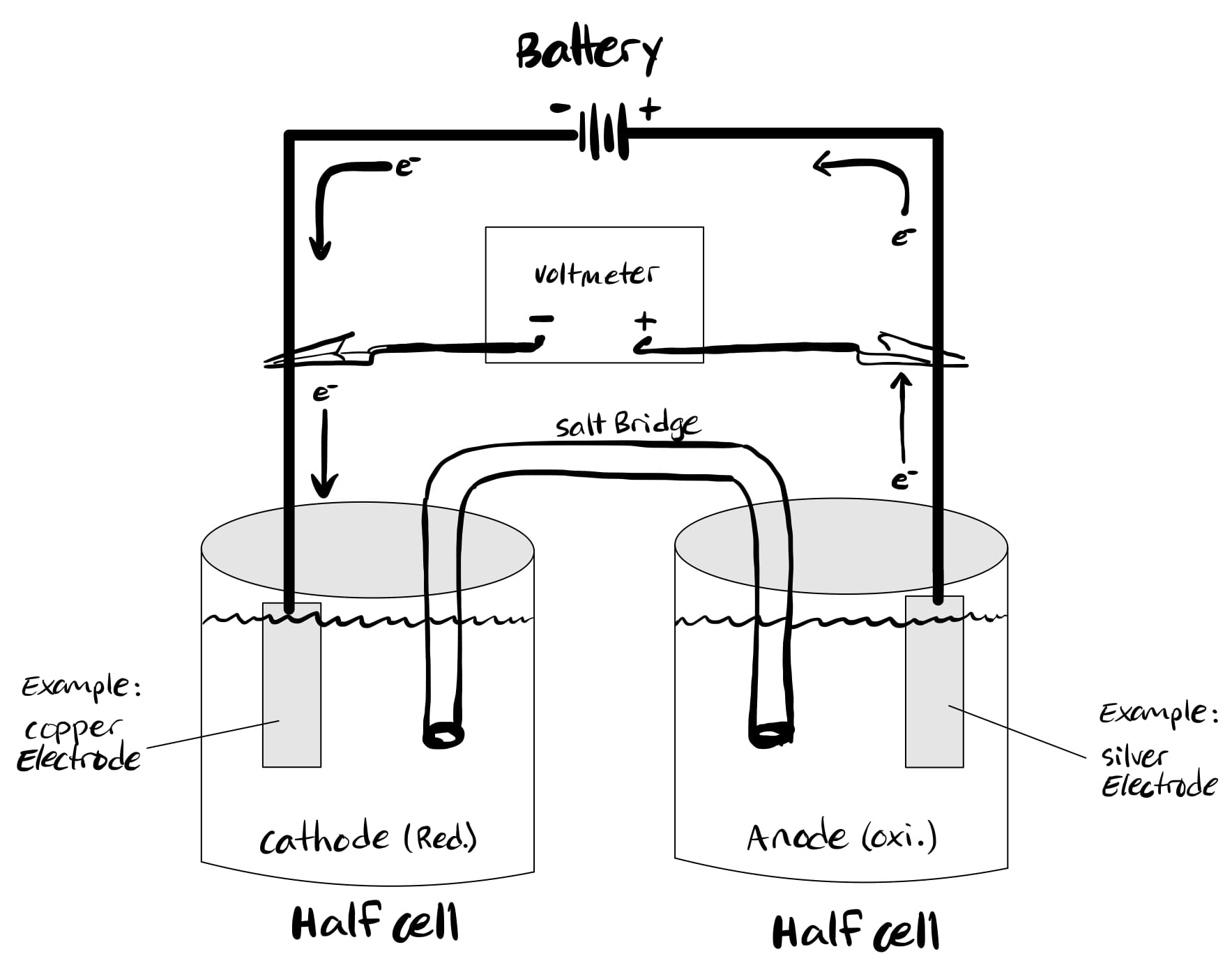
Kas ir elektrolītiskās šūnas?
Kamēr volta (galvaniskās) šūnas vada spontānas ķīmiskas reakcijas, elektrolītiskos elementus vada ne-spontānas redoksreakcijas.
Tas pārvērš elektrisko enerģiju ķīmiskajā enerģijā, tieši pretēji galvaniskajiem elementiem. Elektrolītiskajā šūnā, oksidācija notiek pie katoda, bet reducēšana notiek pie anoda.
Tas dažkārt rada apjukumu, jo anodā notiek oksidēšanās. Tātad ir vieglāk atcerēties, ka elektrolītiskajā šūnā anods ir pozitīvs, bet katods ir negatīvs.
Kopējā Gibsa enerģija ir pozitīva, jo reakcijas nav spontānas. Elektrolītiskās šūnas var izmantot noteiktu savienojumu, piemēram, ūdens, elektrolīzei.
Ja ūdens tiek elektrolizēts, izmantojot elektrolītisko elementu, notiks gāzveida skābekļa un ūdeņraža veidošanās.
Elektrolītiskās šūnas mehānismu var labi saprast, izmantojot izkausēta nātrija hlorīda (NaCl) piemēru. Šūnu reakcijas ir norādītas zemāk.
Katodā: [Na+ + e– → Na] x 2 (samazināts)
Pie anoda: 2Cl– → Cl2 + 2e– (oksidēts)
Šūnu reakcija: 2NaCl → 2Na + Cl2
Lai veiktu iepriekš minētās reakcijas, divus elektrodus iegremdē izkausētajā NaCl un, kad elektrība tiek izlaista caur ķēdi, katods kļūst negatīvi uzlādēts.
Tātad nātrija joni (pozitīvi lādēti) tiek piesaistīti katodam un tādējādi reducējot veidojas metālisks nātrijs.
Galvenās atšķirības starp galvaniskajām šūnām un elektrolītiskajām šūnām
- Galvaniskās šūnas ir elektroķīmiskās šūnas, kas var ražot elektrību, turpretim elektrolītiskās šūnas ir arī elektroķīmiskās šūnas, taču tās izmanto elektrisko enerģiju, lai veicinātu ķīmiskās reakcijas.
- Galvaniskās šūnas pārvērš ķīmisko enerģiju elektroenerģijā, savukārt elektrolītiskās šūnas pārvērš elektrisko enerģiju ķīmiskajā enerģijā.
- Galvaniskajā šūnā notiek spontāna reakcija, savukārt elektrolītiskos šūnās notiek ne-spontānas redoksreakcijas.
- Galvaniskajā šūnā negatīvais lādiņš atrodas pie anoda, bet pozitīvais lādiņš ir pie katoda, turpretim elektrolītiskajā šūnā tas ir pretējs.
- Oksidācijas process notiek galvaniskajā elementā pie anoda, bet elektrolītiskās šūnas gadījumā tas notiek katodā.
- Puse elementi tiek ievietoti dažādos traukos galvaniskajā elementā, turpretim elektrolītiskajās šūnās elektrodi atrodas vienā konteinerā.
- https://avesis.marmara.edu.tr/yayin/17177586-0673-4859-9b7c-66eafdae92d7/prospective-teachers-conceptual-understanding-of-electrochemistry-galvanic-and-electrolytic-cells
- https://onlinelibrary.wiley.com/doi/abs/10.1002/(SICI)1098-2736(199704)34:4%3C377::AID-TEA7%3E3.0.CO;2-O
Pēdējo reizi atjaunināts: 30. gada 2023. jūnijā

Pijušs Jadavs pēdējos 25 gadus ir pavadījis, strādājot par fiziķi vietējā sabiedrībā. Viņš ir fiziķis, kurš aizrautīgi cenšas padarīt zinātni pieejamāku mūsu lasītājiem. Viņam ir bakalaura grāds dabaszinātnēs un pēcdiploma diploms vides zinātnē. Vairāk par viņu varat lasīt viņa vietnē bio lapa.


Lielisks raksts, kurā ļoti skaidri izskaidrotas atšķirības starp galvaniskajiem un elektrolītiskajiem elementiem un to dažādajiem pielietojumiem. Daniela šūnas reakcija un izkausēta nātrija hlorīda piemērs bija ļoti noderīgi. Ļoti izsmeļošs un izsmeļošs skaidrojums.
Šis raksts sniedz labu galvanisko un elektrolītisko elementu salīdzinājumu. Tomēr šķiet, ka autors ir uzņēmies pārāk lielu brīvību tehniskā ziņā. To varēja saprast vienkāršāk.
nepiekrītu. Ja mēģināt apgūt tādu sarežģītu priekšmetu kā šis, jums jābūt gatavam tikt galā ar tehniskajiem terminiem un jēdzieniem.
ES jūtos tāpat. Tas ir daudz informācijas, kas jāpatērē vienlaikus.
Ir ļoti interesanti lasīt, kā šīs šūnas darbojas un to dažādās pielietošanas iespējas. Lieliski piemēri, viegli saprotami tiem, kam ir pieredze zinātnē.
Piemēri noteikti bija labākā daļa. Tie padarīja informāciju daudz vieglāk uztveramu.
Tas ir ļoti informatīvs, taču skaidrojums ir pārāk tehnisks un var būt grūti saprotams plašai sabiedrībai.
Izmantotā terminoloģija ir ļoti attīstīta, un, lai to izprastu padziļināti, var būt nepieciešamas dažas priekšzināšanas zinātnē vai inženierzinātnēs.
Rakstnieks paveica labu darbu, izskaidrojot divu veidu šūnas. Tāpat prieks, ka šis teksts neatrodas mācību grāmatās.
Vidusskolniekam to būtu grūti saprast. Tas jāpublicē inženierzinātņu studentiem vai zinātniekiem.
Es piekrītu Laurenam šajā jautājumā. Šis ir vairāk paaugstināta līmeņa zinātnes kursa materiāls.
Šis ir ļoti informatīvs raksts, lasiet vairākus rakstus, bet man tas šķita ļoti visaptverošs, tas aptver visus būtiskos pamatus un daudz ko citu. Tieši tas, ko meklēju.