In de organische chemie zijn deze termen van groot belang. Hoewel ze vrij veel op elkaar lijken, verschillen ze enorm in hun aard en functionaliteit.
Sommige elementen zijn stabiel bij kamertemperatuur en kunnen in verschillende formules of verschillende arrangementen voorkomen. Het kan uit een enkel element of uit meerdere elementen bestaan.
Allotropen en isomeren zijn de beste voorbeelden van dergelijke elementen. Isomeren hebben dezelfde molecuulformule maar een andere structuurformule.
Aan de andere kant zijn allotropen chemische verbindingen met structurele modificaties van een element. Ze werken op verschillende parameters.
Allotropen en isomeren zijn twee verschillende soorten elementen of verbindingen. Meestal zijn dit stabiele en natuurlijk gevonden verbindingen.
Key Takeaways
- Allotropen zijn verschillende vormen van een element met verschillende fysische en chemische eigenschappen.
- Isomeren zijn verbindingen met dezelfde moleculaire formule maar verschillende moleculaire structuren.
- Beide concepten laten zien hoe atomen zichzelf kunnen rangschikken om unieke substanties te creëren.
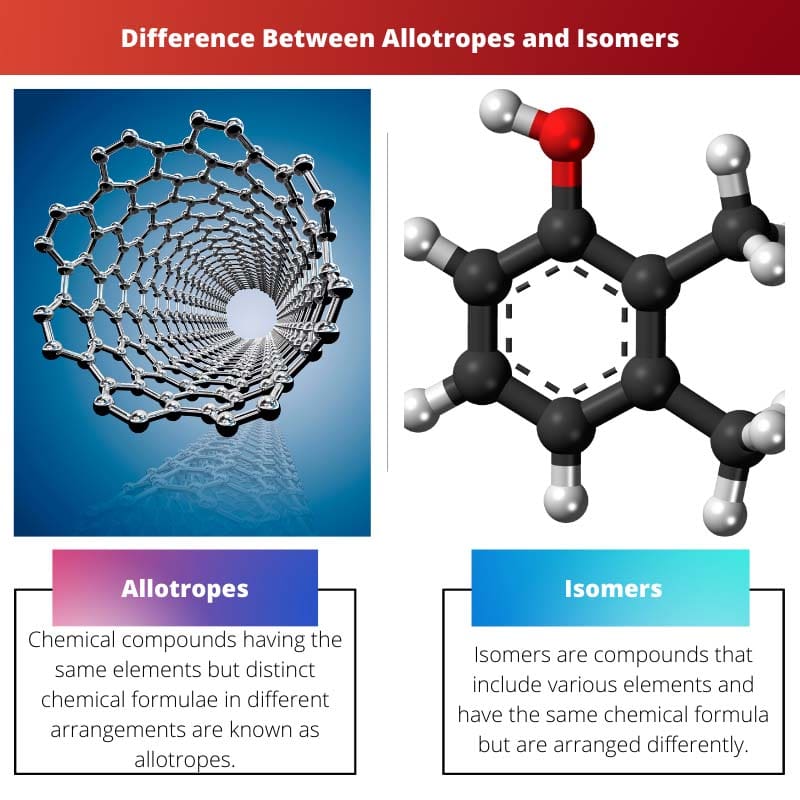
Allotropen versus isomeren
Allotropen zijn samengesteld uit een ander aantal atomen, terwijl isomeren zijn samengesteld uit hetzelfde aantal atomen. Allotropen zijn samengesteld uit hetzelfde enkele element, terwijl Isomeren uit verschillende elementen zijn samengesteld. Allotropen hebben verschillende structuren, terwijl isomeren vergelijkbare structuren hebben.
Allotropen zijn samengesteld uit een enkel element. Veel chemische verbindingen worden gevormd door een enkel element dat in meer dan één vorm kan voorkomen.
Door hun samenstelling hebben ze vergelijkbare eigenschappen. De structurele modificatie van hetzelfde element resulteert in verschillende verbindingen.
Aan de andere kant zijn isomeren samengesteld uit verschillende elementen. Bovendien hebben ze een vergelijkbare molecuulformule en hetzelfde aantal atomen.
Maar deze verbindingen hebben een andere structuurformule die resulteert in de vorming van isomeren. En eigenschappen zijn mogelijk niet hetzelfde vanwege de samenstelling.
Vergelijkingstabel
| Parameters van vergelijking: | allotropen | isomeren |
|---|---|---|
| Definitie | Chemische verbindingen met dezelfde elementen maar verschillende chemische formules in verschillende arrangementen staan bekend als allotropen. | Isomeren zijn verbindingen die verschillende elementen bevatten en dezelfde chemische formule hebben, maar anders zijn gerangschikt |
| Aantal atomen | Het is samengesteld uit verschillende aantallen atomen | Het heeft hetzelfde aantal atomen. |
| Soorten elementen | Het heeft hetzelfde enkele element | Het heeft verschillende elementen |
| Structuur | Het heeft altijd verschillende structuren. | Het kan vergelijkbare of verschillende structuren hebben. |
| Aanwezigheid | Meestal aanwezig in metalen, niet-metalen, metalloïden. | Het kan worden gezien in organische moleculen en anorganische moleculen. |
| Grote soorten | Het omvat metalen allotropen, niet-metalen allotropen en metalloïden allotropen. | Er zijn hoofdzakelijk twee vormen aanwezig; structurele isomeren en stereo-isomerie. |
Wat zijn allotropen?
Allotropen zijn chemische elementen die in meer dan één vorm in dezelfde fysieke toestand kunnen voorkomen. Deze staan bekend als allotropen.
Hetzelfde element met verschillende structurele modificaties resulteert in verschillende verbindingen. Meestal worden elementen op een andere manier met elkaar verbonden.
Allotropie wordt alleen gebruikt voor elementen, niet voor verbindingen. Het gebruik is echter beperkt tot alleen vaste materialen zoals kristallen. Er wordt naar verwezen als verschillende vormen van een element binnen dezelfde fysieke staat.
Het enige verschil in de fysieke toestand zal allotropen zijn. Bovendien is er ook een verschil in moleculaire formules of een verschil in de kristallijne structuur.
Er kunnen bijvoorbeeld twee allotropen van zuurstof bestaan in vaste, vloeibare en gasvormige toestanden (O2 en O3).
Andere elementen, zoals fosfor, behouden geen afzonderlijke allotropen in verschillende fysieke toestanden; wanneer fosfor bijvoorbeeld in een vloeibare toestand wordt gesmolten, keren al zijn vaste allotropen terug naar de identieke P4-vorm.

Wat zijn isomeren?
Chemische verbindingen met vergelijkbare molecuulformules maar met verschillende structuurformules staan bekend als isomeren. Hoewel ze verschillende atomaire rangschikkingen hebben, hebben ze hetzelfde aantal atomen. Meestal bestaan ze uit verschillende elementen.
Isomeren hebben hetzelfde aantal en hetzelfde type atomen, maar deze atomen zijn op verschillende manieren gerangschikt. Als gevolg hiervan verschillen de chemische structuren van isomeren van elkaar.
Ze hebben niet noodzakelijkerwijs dezelfde fysische of chemische eigenschappen, tenzij hun functionele groep vergelijkbaar is.
Er worden twee soorten isomerie gevonden; structurele of constitutionele isomerie en stereo-isomerie of ruimtelijke isomerie. Structurele isomerie ontstaat doordat atomen en functionele groepen op verschillende manieren zijn vastgemaakt.
Aan de andere kant resulteert stereo-isomerie als gevolg van verschillen in geometrische positionering.
Belangrijkste verschillen tussen allotropen en isomeren
Allotropen en isomeren onderscheiden zich door het feit dat het verbindingen zijn die uit hetzelfde enkele element bestaan, maar met verschillende chemische formules in verschillende rangschikkingen.
Terwijl isomeren chemische verbindingen zijn die zijn samengesteld uit verschillende elementen met een vergelijkbare molecuulformule maar een andere structuurformule.
- Beide zijn chemische verbindingen, maar allotropen zijn samengesteld uit dezelfde enkele elementen, en aan de andere kant zijn isomeren samengesteld uit verschillende elementen.
- Allotropen hebben verschillende chemische formules in verschillende arrangementen, terwijl isomeren een andere structuurformule hebben.
- Isomeren hebben hetzelfde aantal atomen, terwijl allotropen een ander aantal atomen hebben.
- Dezelfde eigenschappen zijn te zien in allotropen vanwege vergelijkbare samenstellingen. Hoewel isomeren geen vergelijkbare eigenschappen vertonen, omdat dit afhangt van de functionaliteitsgroep.
- Allotropen worden aangetroffen in chemische elementen, terwijl isomeren worden aangetroffen in moleculen of polyatomaire ionen.
Allotropieresultaten zijn het gevolg van vele factoren, zoals druk, licht en temperatuur. Isomerie wordt veroorzaakt door verschillen in de mechanismen van verbindende atomen en door verschillen in de configuraties van atomen of groepen in de ruimte.
- https://pubs.acs.org/doi/pdf/10.1021/ed064p404
- https://www.nature.com/articles/nmat2885
- https://pubs.acs.org/doi/full/10.1021/cr940246k
- https://link.springer.com/article/10.1007/s10698-020-09383-3
Laatst bijgewerkt: 09 augustus 2023

Piyush Yadav heeft de afgelopen 25 jaar als natuurkundige in de lokale gemeenschap gewerkt. Hij is een natuurkundige die gepassioneerd is om wetenschap toegankelijker te maken voor onze lezers. Hij heeft een BSc in natuurwetenschappen en een postdoctoraal diploma in milieuwetenschappen. Je kunt meer over hem lezen op zijn bio pagina.


De uitgebreide uitleg van de verschillen tussen allotropen en isomeren is van grote waarde voor iedereen die scheikunde studeert en vereist een dieper begrip van deze concepten.
Precies, het is zeer informatief en biedt geweldige inzichten in allotropen en isomeren.
Ik ben het daar volledig mee eens. Het artikel biedt een uitgebreide vergelijkingstabel en voorbeelden, die uiterst nuttig zijn om de verschillen te begrijpen.
De vergelijkingen en verschillen tussen allotropen en isomeren worden in dit artikel goed afgebakend en bieden een waardevol leermiddel voor diegenen die geïnteresseerd zijn in scheikunde.
Ik vond de beschrijving van allotropen en isomeren duidelijk en uitgebreid, waardoor mijn begrip van deze chemische concepten werd vergroot.
Ik ben het ermee eens dat de gedetailleerde beschrijvingen in combinatie met de vergelijkingstabel bijdragen aan een uitgebreid begrip van allotropen en isomeren.
De gedetailleerde informatie over allotropen en isomeren, inclusief de beschrijving van het verschil in hun fysische en chemische eigenschappen, is zeer verhelderend.
Ik ben het ermee eens dat het artikel complexe concepten vereenvoudigt, waardoor het gemakkelijker wordt om deze significante verschillen te begrijpen.
Ik vond dit artikel zeer informatief, vooral omdat het duidelijk de belangrijkste verschillen tussen allotropen en isomeren uitlegt.
De gedetailleerde beschrijvingen en vergelijkingen tussen allotropen en isomeren zijn duidelijk en grondig, waardoor een uitgebreid begrip van deze complexe chemische elementen wordt vergemakkelijkt.
De discussie over allotropen en isomeren in dit artikel is zeer leerzaam en biedt een gedetailleerde analyse van hun verschillen.
De gedetailleerde uitleg en vergelijking tussen allotropen en isomeren bieden waardevolle inzichten voor het begrijpen van de chemie achter deze concepten.
De opheldering van de verschillen tussen allotropen en isomeren is zeer informatief, waardoor het gemakkelijker wordt om deze complexe chemische structuren te begrijpen.
Het artikel geeft een uitgebreid overzicht van allotropen en isomeren, en verduidelijkt de verschillen tussen deze chemische verschijnselen.
Dit artikel biedt uitstekende definities van elke term en een gedetailleerde vergelijking van de eigenschappen ertussen, waardoor deze complexe concepten gemakkelijker te begrijpen zijn.
Het artikel legt op effectieve wijze het onderscheid tussen allotropen en isomeren uit, waardoor deze wetenschappelijke concepten toegankelijker worden voor een breder publiek.
Ik heb dankzij dit artikel een dieper inzicht gekregen in allotropen en isomeren dankzij de duidelijke en beknopte uitleg.
Absoluut, de duidelijke uitleg en voorbeelden helpen bij het begrijpen van de nuances tussen deze chemische concepten.
De gedetailleerde beschrijvingen en de vergelijkingstabel hebben het gemakkelijker gemaakt om de belangrijkste verschillen tussen allotropen en isomeren te begrijpen, waardoor dit artikel een waardevolle bron is voor het begrijpen van deze chemische concepten.
De uitgebreide informatie die is verstrekt over allotropen en isomeren heeft mijn kennis van deze cruciale chemische elementen aanzienlijk verrijkt.
Dit artikel is een uitstekende bron voor het begrijpen van allotropen en isomeren vanwege de gedetailleerde beschrijvingen en verduidelijkingen van hun onderscheidingen.
De gedetailleerde uitleg van allotropen en isomeren in dit artikel vergroot het begrip van deze concepten en biedt waardevolle inzichten voor degenen die zich met chemie bezighouden.
De inzichten in de verschillen tussen allotropen en isomeren die in dit artikel worden genoemd, zijn zeer nuttig bij het begrijpen van deze chemische verschijnselen.
De vergelijkingstabel is vooral nuttig bij het benadrukken van de belangrijkste verschillen tussen allotropen en isomeren, en biedt een duidelijk overzicht van hun verschillen.
De vergelijkingstabel is inderdaad erg handig. Het vat op effectieve wijze de punten van differentiatie tussen de twee concepten samen.