Scheikunde is een heel interessant onderwerp onder alle andere. Het omvat bindingen, resonantie, levendige verbindingen, chemische reacties, enz.
In de chemie geven verbindingen aanleiding tot ionen, kationen, anionen, elektronen, enz. De belangrijkste attractie van het onderwerp is het periodiek systeem dat alle elementen op aarde beslaat, natuurlijk of kunstmatig gecreëerd.
Key Takeaways
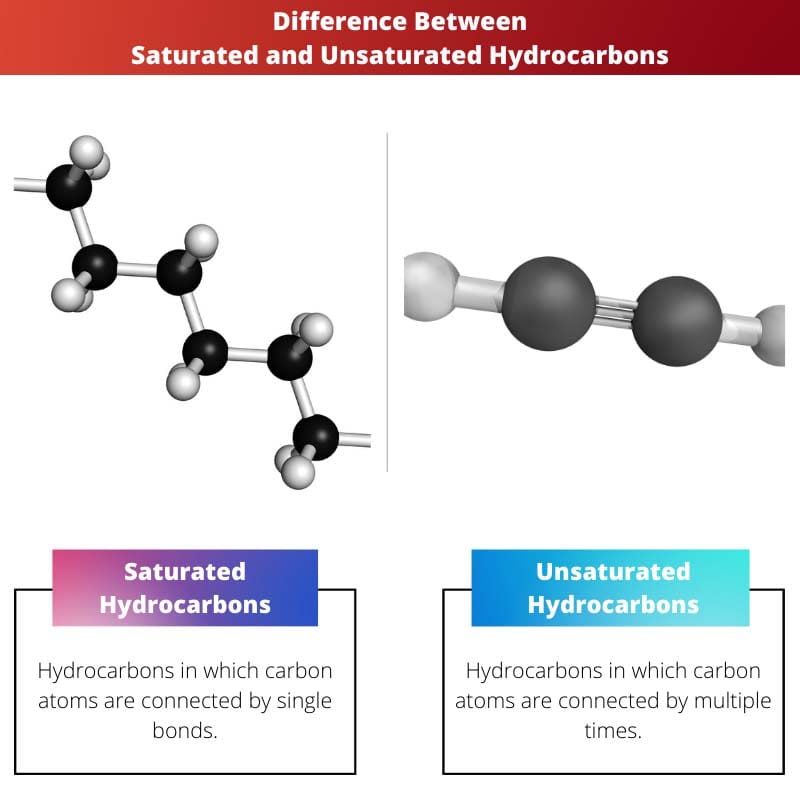
- Verzadigde koolwaterstoffen bevatten enkele bindingen, terwijl onverzadigde koolwaterstoffen dubbele of driedubbele bindingen bevatten.
- Verzadigde koolwaterstoffen zijn vaste stoffen of vloeistoffen bij kamertemperatuur, terwijl onverzadigde koolwaterstoffen gassen of vloeistoffen zijn.
- Verzadigde koolwaterstoffen hebben een hoger smelt- en kookpunt dan onverzadigde koolwaterstoffen.
Verzadigde koolwaterstof versus onverzadigde koolwaterstof
Het verschil tussen verzadigde koolwaterstoffen en onverzadigde koolwaterstoffen is dat de verbinding van verzadigde koolwaterstoffen een enkele binding tussen de twee koolstofatomen bevat of heeft, dwz de twee verschillende koolstofatomen zijn verbonden via een enkele binding ertussen.

Verzadigde koolwaterstof wordt vermeld als koolwaterstoffen die alleen uit koolstof en waterstof bestaan, waarbij de twee koolstofatomen via een enkele binding zijn bevestigd.
De resterende bindingen van de koolstofatomen worden vervuld door de waterstofatomen, zodat er geen meervoudige bindingen ontstaan. Alkanen zijn een voorbeeld van verzadigde koolwaterstoffen.
De verbindingen van alkanen zijn - methaan, ethaan, butaan, pentaan, hexaan, enz.
Onverzadigde koolwaterstof wordt vermeld als koolwaterstoffen die alleen uit koolstof en waterstof bestaan, en de twee waterstofbruggen zijn verbonden door meerdere bindingen.
Onverzadigde koolwaterstoffen hebben twee soorten koolwaterstofverbindingen en er wordt gezegd dat ze alkenen en alkynen zijn.
Voorbeelden van alkenenverbindingen zijn - buteen, hexeen, penteen, etheen, enz., en voorbeelden van alkynenverbindingen zijn - acetyleen, oct-1-yn, 1-hexyn, enz.
Vergelijkingstabel
| Parameters van vergelijking: | Verzadigde koolwaterstof | Onverzadigde koolwaterstof |
|---|---|---|
| Definitie | Koolwaterstoffen waarin koolstofatomen zijn verbonden door enkelvoudige bindingen | Koolwaterstoffen waarin koolstofatomen meerdere keren met elkaar verbonden zijn |
| Soorten koolwaterstoffen | Twee soorten: alkanen en cycloalkanen | Drie soorten: alkenen, alkynen, aromatisch |
| Hybridisatie | sp3 | sp2 of sp1 |
| Waterstof Atomen | Meer aantal atomen | Minder aantal atomen |
| Chemische reactiviteit | Laag | Hoge |
| Vlamtest | Geeft een blauwe vlam | Geeft een roetige vlam (of aardekleurig) |
| Voorbeeld | Alkanen, Cycloalkaan, Butaan, Pentaan | Alkynen, alkenen, aromatisch, acetyleen |
Wat is verzadigde koolwaterstof?
Verzadigde koolwaterstoffen worden gedefinieerd als de koolwaterstof gevormd door twee koolstofatomen met daartussen een enkele binding. De rest van de bindingen zijn verbonden of gevormd door de waterstofatomen om de koolstofvalentie te vervullen.
De algemene formule die wordt gebruikt om de verzadigde koolwaterstof te genereren is – CnH2n+2.
Verzadigde koolwaterstoffen zijn van twee hoofdtypen: alkanen en cycloalkanen. Sommige van de alkaanverbindingen zijn - methaan, ethaan, propaan, butaan, pentaan, enz.
Cycloalkanen zijn verbindingen met ringstructuren en gehybridiseerde atomen. De eigenschappen van cycloalkanen zijn bijna gelijk aan die van alkanen behalve het kook- en smeltpunt, die relatief hoger zijn.
De volgende zijn de eigenschappen of het gebruik van de verzadigde koolwaterstoffen -
- Verzadigde koolwaterstoffen bevatten een groter aantal waterstofatomen in hun verbindingen.
- Methaan - de eerste alkaanverbinding is erg nuttig en kan worden gebruikt als raketbrandstof of in auto's, verwarmingstoestellen, enz.
- Alkanen en cycloalkanen zijn twee significant verschillende soorten verzadigde koolwaterstoffen.
- Cycloalkanen kunnen worden gebruikt voor de productie van nylon, petroleumgas, rubbers, enz.
- Ethaan, de tweede alkaanverbinding, is het koelmiddel van de koelkast. Het speelt ook een belangrijke rol bij de productie van ethyleen.
Wat is onverzadigde koolwaterstof?
Onverzadigde koolwaterstoffen worden gedefinieerd als de koolwaterstof gevormd door twee koolstofatomen met meerdere bindingen daartussen. De meervoudige bindingen kunnen dubbele bindingen of driedubbele bindingen zijn.
De latere valentie van de koolstof wordt vervuld door de waterstofatomen. De algemene formule van de onverzadigde koolwaterstof is voor alkenen – CnH2n, en voor de alkynen is – CnH2n-2.
De onverzadigde koolwaterstoffen zijn belangrijk in drie typen: alkenen, alkynen en aromatische verbindingen. De eigenschappen van de aromatische verbindingen zijn niet dezelfde als die van de alkenen en alkynen.
Ook zijn deze verbindingen relatief stabieler dan die van alkenen of alkynen.
De volgende zijn de eigenschappen of het gebruik van de onverzadigde koolwaterstoffen -
- Om een onverzadigde koolwaterstof te vormen, zijn de waterstofatomen kleiner in aantal samen met de meervoudige bindingen (dubbele of driedubbele binding).
- De twee koolstofatomen die aan de onverzadigde koolwaterstof zijn bevestigd, vormen een bindingshoek van ongeveer 120 graden.
- De meest voorkomende aromatische koolwaterstof, benzeen, vormt een bindingshoek van 120 graden met andere atomen.
- Bij elke reactie vindt verbranding plaats wanneer water of koolstofdioxide wordt gevormd.
- Oxidatiereacties worden veroorzaakt door het optellen of aftrekken van de waterstofatomen in de reactie.
Belangrijkste verschillen tussen verzadigde en onverzadigde koolwaterstoffens
- Verzadigde koolwaterstoffen zijn de koolwaterstoffen die worden gevormd met koolstof- en waterstofatomen, en de twee koolstofatomen zijn gebonden door een enkele binding, terwijl aan de andere kant onverzadigde koolwaterstoffen de koolwaterstoffen zijn die ook worden gevormd met de koolstof- en waterstofatomen en de koolstofatomen zijn verbonden door de meervoudige bindingen en het kan een dubbele binding of een drievoudige binding zijn.
- Verzadigde koolwaterstoffen zijn van hoofdzakelijk twee soorten, en zijn - alkanen en cycloalkanen, terwijl daarentegen onverzadigde koolwaterstoffen van hoofdzakelijk drie soorten zijn en dat zijn - alkenen, alkynen en aromatische verbindingen.
- De hybridisatie getoond door de verzadigde koolwaterstoffen is sp3, terwijl aan de andere kant relatief de hybridisatie getoond door de onverzadigde koolwaterstoffen sp2 is voor alkenen en sp1 of sp voor de alkynen.
- De aanwezigheid van het aantal waterstofatomen in de verzadigde verbindingen is hoger, terwijl daarentegen de aanwezigheid van het aantal waterstofatomen in de onverzadigde verbindingen lager is.
- De chemische reactiviteit die wordt getoond door de verzadigde verbindingen is laag in vergelijking, aan de andere kant is de chemische reactiviteit die wordt getoond door de onverzadigde verbinding hoog.
- De vlamtest die door de verzadigde verbindingen wordt getoond, is de blauwe vlam, terwijl aan de andere kant de vlamtest die door de onverzadigde verbindingen wordt getoond, de roetvlam (of de aardekleurige vlam) is.
- Voorbeelden van verzadigde koolwaterstoffen zijn - alkanen, cycloalkanen, butaan, hexaan, octaan, enz., Terwijl daarentegen de voorbeelden van onverzadigde koolwaterstoffen zijn - aromatische verbindingen, alkynen en alkeen.
- https://www.sciencedirect.com/science/article/abs/pii/S0376738800006232
- https://pubs.acs.org/doi/abs/10.1021/ct300215p
- https://www.frontiersin.org/articles/10.3389/fchem.2014.00075/full
- https://cdnsciencepub.com/doi/abs/10.1139/v71-612
Laatst bijgewerkt: 25 juli 2023

Piyush Yadav heeft de afgelopen 25 jaar als natuurkundige in de lokale gemeenschap gewerkt. Hij is een natuurkundige die gepassioneerd is om wetenschap toegankelijker te maken voor onze lezers. Hij heeft een BSc in natuurwetenschappen en een postdoctoraal diploma in milieuwetenschappen. Je kunt meer over hem lezen op zijn bio pagina.


Het gedeelte over de belangrijkste verschillen tussen verzadigde en onverzadigde koolwaterstoffen geeft een duidelijk overzicht van de verschillende chemische eigenschappen. Dit is gunstig voor zowel studenten als professionals.
De gedetailleerde uitleg van verzadigde en onverzadigde koolwaterstoffen en hun chemische eigenschappen zijn zeer nuttig. De informatie wordt hier op een duidelijke en georganiseerde manier gepresenteerd.
Ik vond het gedeelte over het gebruik van verzadigde koolwaterstoffen en onverzadigde koolwaterstoffen bijzonder interessant. Het is fascinerend om te zien hoe deze verbindingen in verschillende industrieën worden toegepast.
Absoluut! Het begrijpen van hun toepassingen in de echte wereld helpt het belang van deze verbindingen in het dagelijks leven te begrijpen.
De vergelijkingstabel in het artikel is bijzonder nuttig om snel het onderscheid tussen verzadigde en onverzadigde koolwaterstoffen te begrijpen. Goed gedaan!
Leuk artikel! Het biedt een uitgebreid overzicht van de verschillen tussen verzadigde en onverzadigde koolwaterstoffen, wat essentieel is voor het begrijpen van de grondbeginselen van de chemie.
Ik ben het er helemaal mee eens! Het artikel legt de concepten heel duidelijk en beknopt uit.
Het artikel heeft een grondige uitleg gegeven van de chemische reactiviteit en eigenschappen van verzadigde en onverzadigde koolwaterstoffen. Dit soort gedetailleerd inzicht is cruciaal op het gebied van de chemie.
Ik waardeer de gedetailleerde informatie over het gebruik van verzadigde en onverzadigde koolwaterstoffen. Het helpt om de praktische betekenis van deze verbindingen in ons dagelijks leven te begrijpen.
Dit artikel schetst mooi de chemische eigenschappen en verschillen tussen verzadigde en onverzadigde koolwaterstoffen. Het is een geweldige bron voor studenten en iedereen die geïnteresseerd is in scheikunde.
De gedetailleerde uitleg van verzadigde koolwaterstoffen, onverzadigde koolwaterstoffen en hun eigenschappen is zeer informatief. Het is geweldig om zulke duidelijke informatie op één plek te hebben.