العالم هو مكان جميل. تتكون الذرات من الجبال والبحر والسماء وكل الأشياء الموجودة ماديًا.
إنها اللبنات الأساسية للكون. ومع ذلك ، الذرات ليست مستقرة. ومن ثم ، فإنها تثبت نفسها عن طريق صنع الجزيئات والأيونات.
الوجبات السريعة الرئيسية
- الجزيء عبارة عن مجموعة من ذرتين أو أكثر مرتبطة كيميائيًا معًا ، بينما الأيون عبارة عن ذرة أو جزيء بشحنة كهربائية.
- الجزيئات محايدة ، في حين أن الأيونات يمكن أن تكون موجبة أو سالبة الشحنة.
- تتشكل الجزيئات من خلال الرابطة التساهمية ، بينما تتشكل الأيونات من خلال انتقال الإلكترونات بين الذرات.
جزيء مقابل أيون
تختلف الجزيئات والأيونات لأن الجزيء ليس له شحنة صافية ، بينما الأيون له شحنة. يحدث هذا لأن كل شيء في هذا الكون يريد تحقيق التوازن.
تقوم الذرات بذلك عن طريق تكوين الجزيئات والأيونات. أيضًا ، يتم تطوير الجزيئات من خلال مشاركة الإلكترونات ، بينما تتشكل الأيونات بسبب تبادل الإلكترونات.
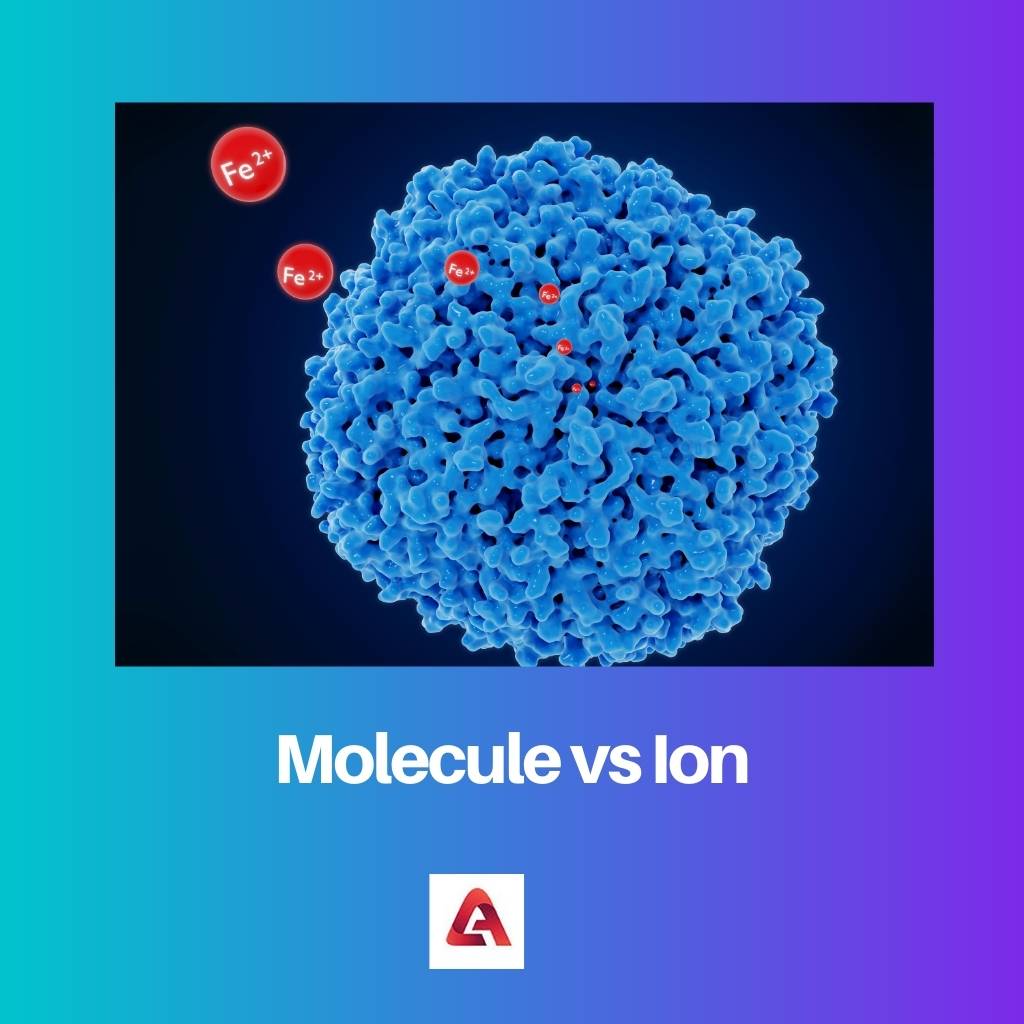
تشكل ذرة واحدة أو أكثر روابط تساهمية لتصبح جزيءًا. أصغر وحدة تتكون منها المادة هي الجزيء. يحتفظ الجزيء بجميع الخصائص الكيميائية للجوهر. تصور الذرات الجزيئات ، ممثلة باستخدام الدوائر ، وتشكل الروابط معًا.
تُعرف الأنواع الكيميائية ذات الشحنة الموجبة أو السالبة الصافية بالأيون. ان ذرة والجزيء يمكن أن يطلق عليه أيون إذا كان لديهم حسابات صافي غير صفرية. ومن ثم ، فإن جميع الأيونات إما تحتوي على إلكترونات أكثر من البروتونات أو عدد بروتونات أكثر من الإلكترونات في تركيبها الجزيئي أو الذري.
جدول المقارنة
| معلمات المقارنة | مركب | ايون |
|---|---|---|
| توزيع الإلكترون | تتشكل الجزيئات بسبب مشاركة الإلكترونات بين ذرتين أو أكثر أو بواسطة أيونين مشحونين بشكل معاكس. | تتشكل الأيونات عندما تكتسب الذرات أو تفقد شحنتها لتحقيق تكوين غاز نبيل. |
| مقاس | يعتمد حجم الجزيء على حجم الذرات أو الأيونات المشاركة في تكوين الرابطة. | الأنيونات أكثر أهمية من الجزيئات الأم ، والكاتيونات أقل أهمية من الجزيئات الأم. |
| استقرار | الجزيئات أكثر استقرارًا من الأيونات. | الأيونات أقل استقرارًا من الجزيئات. |
| تكوين | تشكل الروابط التساهمية أو الروابط الأيونية جزيئات. | تتشكل الأيونات عن طريق الرابطة الأيونية بين أيونيين من الشحنة المعاكسة وتكون أكثر قوة من التساهمية. |
| توصيل الكهرباء | نظرًا لأن الجزيئات ليس لها أي شحنة صافية ، فهي ليست موصلة جيدة للكهرباء. | الأيونات موصلة جيدة للكهرباء. |
ما هو الجزيء؟
تُعرف أصغر وحدة في المركب ، والتي تُظهر الخصائص الكيميائية للمركب ، بالجزيء. تتكون الجزيئات من ذرتين أو أكثر مرتبطة تساهميًا معًا ، أي أنها تشترك في إلكترون واحد أو أكثر.
تتكون الجزيئات من معظم أجزاء الأرض ، وتتكون جميع المواد العضوية تقريبًا من جزيئات.
يمكن أن تكون الجزيئات متجانسة النوى وغير متجانسة ، مما يعني أنها تتألف من نفس العناصر أو عناصر مختلفة ، على التوالي.
تتشكل الرابطة التساهمية عندما تشترك ذرتان بهما ثماني بتات غير مكتملة في البتات. الرابطة التساهمية تحول الذرات المختلفة إلى جزيء.
تتكون الجزيئات من ذرات مجمعة معًا إما من خلال روابط تساهمية أو روابط أيونية.
الجزيئات المرتبطة تساهميًا أضعف من الجزيئات الأيونية المرتبطة. يحدث هذا لأن الروابط الأيونية لها قوة إلكتروستاتيكية قوية تمسك الأيونات ببعضها البعض.
نتيجة لذلك ، تكون الجزيئات الأيونية أكثر استقرارًا من الجزيئات المرتبطة تساهميًا.

ما هو ايون؟
الأيون هو نوع كيميائي له شحنة موجبة أو سالبة صافية من حيث الحجم. تشير الأيونات إلى الجزيئات والذرات التي لها تحكم صافي غير صفري.
وبالتالي ، تحتوي الأيونات إما على عدد بروتونات أكثر من الإلكترونات أو عدد إلكترونات أكثر من البروتونات في تركيبها الجزيئي أو الذري.
تُعرف الأيونات التي تحتوي على عدد أكبر من الإلكترونات من البروتونات وتحمل صافي شحنة سالبة باسم الأنيونات.
على العكس من ذلك ، تُعرف الأيونات التي تحتوي على عدد أكبر من البروتونات من الإلكترونات والتي تحمل صافي شحنة موجبة باسم الكاتيونات.
تتشكل الروابط الأيونية فقط عندما تنشأ القوى الكهروستاتيكية بين أنيون سالب الشحنة وكاتيون موجب الشحنة.
تجذب هذه القوى الكهروستاتيكية الأنيونات والكاتيونات لبعضها البعض لتثبيت الشحنة الصافية. تساعد هذه القوى الكهروستاتيكية في تكوين المركبات الأيونية.
تسمى الأيونات المكونة من عنصر واحد فقط الأيونات الذرية أو أحادية الذرة. تحتوي الذرات المشاركة على بعض الشحنة الصافية ، سواء كانت موجبة أو سالبة.
في حين أنه إذا كان هناك عنصران أو أكثر متورطان في أيون ، فيتم الإشارة إليهما على أنهما أيونات جزيئية أو متعددة الذرات.
الاختلافات الرئيسية بين الجزيئات والأيونات
- لا تحتوي الجزيئات على شحنة صافية ، بينما تتمتع الأيونات بصافي تحكم إيجابي أو سلبي.
- تتشكل الجزيئات عندما تشترك ذرتان أو أكثر في الإلكترونات لإكمال الثماني ، بينما تتبادل الأيونات الإلكترونات وتتشكل المركبات الأيونية بسبب القوى الكهروستاتيكية.
- نظرًا لأن الأيونات مرتبطة ببعضها البعض بواسطة قوى إلكتروستاتيكية ، فهي أكثر استقرارًا من الجزيئات التي تتكون من الروابط التساهمية.
- نظرًا لقوى الجذب العالية بين أيونيين ، فإن لديهم طاقة شعرية أكثر من الجزيئات المرتبطة تساهميًا.
- بسبب الطاقة الشبكية العالية ، تكون الأيونات أكثر استقرارًا من الرابطة التساهمية.
- يعتمد حجم الجزيئات على الذرات المشاركة في تكوينات الرابطة. الكاتيونات أصغر من الجزيئات الأم ، في حين أن الأنيونات أكثر أهمية من الجزيئات الأم.

- https://ui.adsabs.harvard.edu/abs/1988STIA…8915174M/abstract
- https://pubs.acs.org/doi/pdf/10.1021/ja00260a006
آخر تحديث: 11 يونيو 2023

أمضى بيوش ياداف السنوات الخمس والعشرين الماضية في العمل كفيزيائي في المجتمع المحلي. إنه فيزيائي شغوف بجعل العلم في متناول قرائنا. وهو حاصل على بكالوريوس في العلوم الطبيعية ودبلوم دراسات عليا في علوم البيئة. يمكنك قراءة المزيد عنه على موقعه صفحة بيو.


كان جدول المقارنة الخاص بالمقالة مفيدًا بشكل خاص في فهم الخصائص المميزة للجزيئات والأيونات. إنها نقطة مرجعية رائعة لإجراء مقارنات سريعة.
لقد وجدت أن المقارنات مفيدة جدًا أيضًا. إنها طريقة ملائمة لفهم الفوارق الرئيسية بين الجزيئات والأيونات بسرعة.
قدمت المقالة مقارنة شاملة بين الجزيئات والأيونات، لكنها افتقرت إلى نهج أكثر جاذبية لجعل المحتوى أكثر جذبًا للقراء.
أرى وجهة نظرك. على الرغم من أن المعلومات كانت قيمة، إلا أن السرد الأكثر جاذبية كان من الممكن أن يعزز الجاذبية العامة للمقالة.
يلخص جدول المقارنة الخاص بالمقالة بشكل فعال الاختلافات الرئيسية بين الجزيئات والأيونات. إنها أداة مفيدة لمراجعة المفاهيم وتعزيزها.
قدمت المقالة فهمًا واضحًا وموجزًا للجزيئات والأيونات، وهو أمر مفيد للمبتدئين في مجال الكيمياء.
أنا موافق. إنها نقطة بداية جيدة لأي شخص جديد في الكيمياء، ولكن كان من الممكن أن تتضمن مفاهيم أكثر تقدمًا لأولئك الذين لديهم فهم أعمق للموضوع.
هذه المقالة هي نظرة رائعة على عالم الجزيئات والأيونات. قدمت التفسيرات والمقارنات التفصيلية رؤى عظيمة.
لقد وجدت المادة مفيدة للغاية ومنظمة بشكل جيد. لقد ساعدني ذلك حقًا على فهم الاختلافات بين الجزيئات والأيونات.
أنا أتفق تماما. المعلومات المقدمة تعليمية ومثيرة للاهتمام للغاية.
لقد قامت المقالة بعمل جيد في تبسيط المفاهيم المعقدة، لكنها افتقرت إلى مناقشات متعمقة حول الخصائص الكيميائية وسلوكيات الجزيئات والأيونات.
أنا أتفق معك. على الرغم من أن المقالة قدمت نظرة عامة، إلا أنه كان من الممكن أن تتضمن رؤى أكثر تفصيلاً حول الخواص الكيميائية لهذه الوحدات الأساسية.
وكانت المقارنات المقدمة مفيدة جدًا في فهم الاختلافات بين الجزيئات والأيونات. وأنا أقدر الوضوح في التفسيرات.
لقد وجدت أن المقالة بدائية بعض الشيء. لم يقدم الكثير من العمق لأولئك الذين يبحثون عن معلومات أكثر تقدمًا.
لا يمكن اقبل المزيد. إن وضوح المقالة وبساطتها يجعلها مصدرًا قيمًا لأي شخص مهتم بالكيمياء.
أعتقد أن المقالة تسلط الضوء بشكل فعال على الاختلافات الرئيسية بين الجزيئات والأيونات، مما يسهل فهمها للخبراء غير المتخصصين في الكيمياء.
أعتقد أن المقال بالغ في تبسيط مفاهيم الجزيئات والأيونات. كان من الممكن أن تتعمق أكثر في الكيمياء وراء هذه اللبنات الأساسية.
أفهم وجهة نظرك، ولكن للحصول على نظرة عامة، توفر المقالة نقطة بداية جيدة. من المهم جعل المواضيع المعقدة في متناول جمهور واسع.
وكانت التفسيرات واضحة وموجزة، مما جعل من السهل فهم الاختلافات بين الجزيئات والأيونات. قدمت المقالة أساسًا قويًا لمزيد من التعلم.
لقد وجدت أن وضوح التفسيرات مفيد جدًا أيضًا. إنه أمر رائع لبناء فهم قوي لهذه المفاهيم.