Svět je krásné místo. Hory, moře, obloha a všechny věci, které fyzicky existují, obsahují atomy.
Jsou stavebními kameny vesmíru. Atomy však nejsou stabilní. Proto se samy stabilizují tvorbou molekul a iontů.
Key Takeaways
- Molekula je skupina dvou nebo více atomů chemicky spojených dohromady, zatímco iont je atom nebo molekula s elektrickým nábojem.
- Molekuly jsou neutrální, zatímco ionty mohou být nabité kladně nebo záporně.
- Molekuly se tvoří kovalentní vazbou, zatímco ionty se tvoří přenosem elektronů mezi atomy.
Molekula vs ion
Molekuly a ionty se liší, protože molekula nemá čistý náboj, zatímco iont ano. To se děje, protože vše v tomto vesmíru chce dosáhnout rovnováhy.
Atomy to dělají tvorbou molekul a iontů. Molekuly se také vyvíjejí sdílením elektronů, zatímco ionty se tvoří v důsledku výměny elektronů.
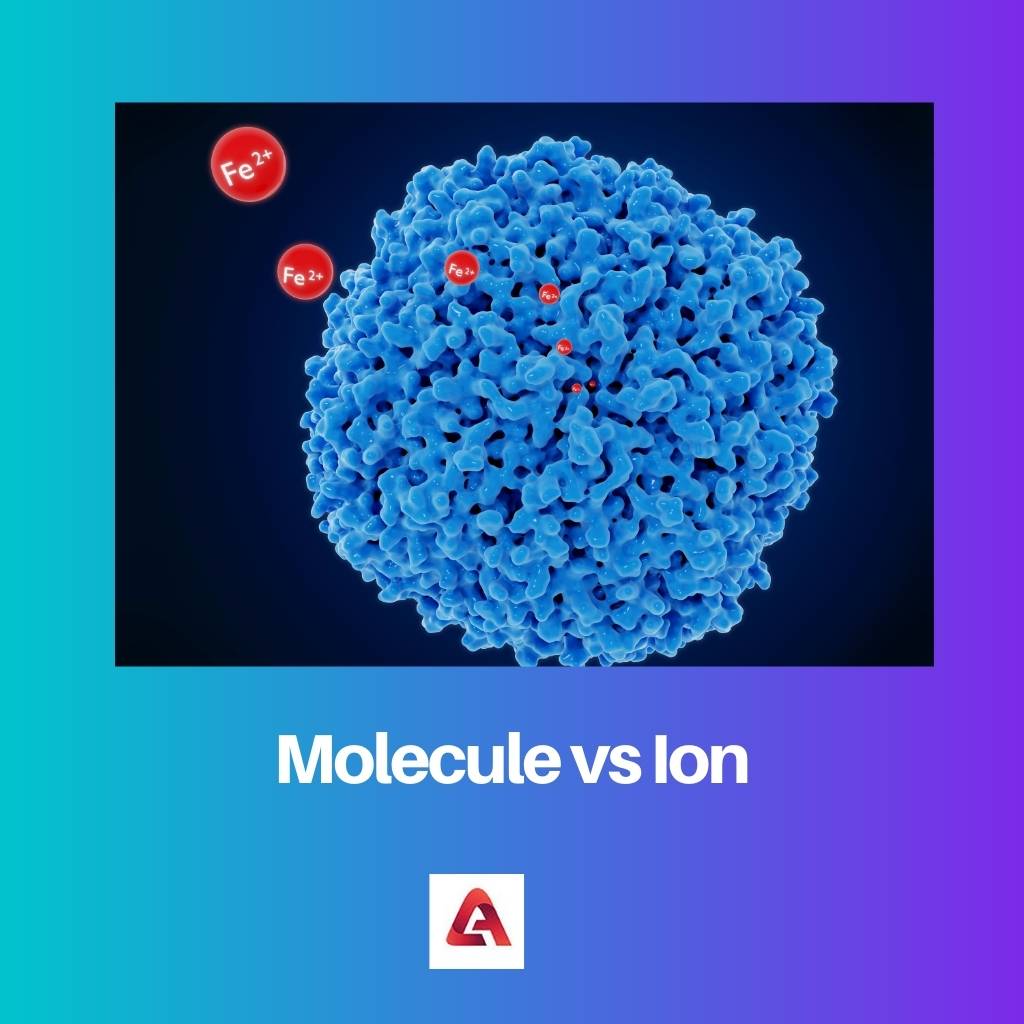
Jeden nebo více atomů tvoří kovalentní vazby, aby se staly molekulou. Nejmenší jednotkou, ze které se látka skládá, je molekula. Molekula si zachovává všechny chemické vlastnosti esence. Atomy znázorňují molekuly, znázorněné pomocí kruhů, které spolu tvoří vazby.
Chemický druh s čistým kladným nebo záporným nábojem je známý jako iont. An atom a molekula může být nazvána iontem, pokud má nenulové čisté účty. Všechny ionty tedy mají ve své molekulární nebo atomové struktuře buď více elektronů než protonů, nebo více protonů než elektronů.
Srovnávací tabulka
| Parametry srovnání | Molekula | ion |
|---|---|---|
| Distribuce elektronů | Molekuly se tvoří díky sdílení elektronů mezi dvěma nebo více atomy nebo dvěma opačně nabitými ionty. | Ionty se tvoří, když atomy získávají nebo ztrácejí náboj, aby dosáhly konfigurace vzácných plynů. |
| Velikost | Velikost molekul závisí na velikosti atomů nebo iontů zapojených do tvorby vazby. | Anionty jsou významnější než rodičovské molekuly a kationty jsou méně významné než rodičovské molekuly. |
| Stabilita | Molekuly jsou stabilnější než ionty. | Ionty jsou méně stabilní než molekuly. |
| výcvik | Kovalentní vazby nebo iontové vazby tvoří molekuly. | Ionty jsou tvořeny iontovou vazbou mezi dvěma ionty opačného náboje a jsou silnější než kovalentní. |
| Vedení elektřiny | Protože molekuly mají nulové čisté náboje, nejsou dobrými vodiči elektřiny. | Ionty jsou dobrými vodiči elektřiny. |
Co je to molekula?
Nejmenší jednotka sloučeniny, která ukazuje chemické vlastnosti sloučeniny, je známá jako molekula. Molekuly se skládají ze dvou nebo více atomů kovalentně vázaných, tj. sdílejí jeden nebo více elektronů.
Molekuly tvoří většinu Země a téměř všechny organické látky jsou tvořeny molekulami.
Molekuly mohou být homonukleární a heteronukleární, což znamená, že obsahují stejné nebo různé prvky.
Kovalentní vazba se vytvoří, když dva atomy s neúplnými oktety sdílejí bity. Kovalentní vazba přemění různé atomy na molekulu.
Molekuly se skládají z atomů seskupených dohromady buď kovalentními vazbami nebo iontovými vazbami.
Kovalentně vázané molekuly jsou slabší než iontově vázané molekuly. To se děje proto, že iontové vazby mají silnou elektrostatickou sílu, která drží ionty pohromadě.
Díky tomu jsou iontové molekuly stabilnější než molekuly s kovalentní vazbou.

Co je to iont?
Iont je chemická látka s kladným nebo záporným nábojem určité velikosti. Ionty se týkají molekul a atomů, které mají nenulovou čistou kontrolu.
Proto mají ionty ve své molekulární nebo atomové struktuře buď více protonů než elektronů, nebo více elektronů než protonů.
Ionty, které mají významnější počet elektronů než protony a mají čistý záporný náboj, jsou známé jako anionty.
Naopak ionty s větším počtem protonů než elektrony a udržující čistý kladný náboj jsou známé jako kationty.
Iontové vazby se tvoří pouze tehdy, když vznikají elektrostatické síly mezi záporně nabitým aniontem a kladně nabitým kationtem.
Tyto elektrostatické síly přitahují anionty a kationty k sobě, aby stabilizovaly čistý náboj. Tyto elektrostatické síly pomáhají při tvorbě iontové sloučeniny.
Ionty tvořené pouze jedním prvkem se nazývají atomové nebo monatomické ionty. Zúčastněné atomy mají určitý čistý náboj, buď kladný nebo záporný.
Zatímco pokud jsou v iontu zahrnuty dva nebo více prvků, označují se jako molekulární nebo polyatomické ionty.
Hlavní rozdíly mezi molekulami a ionty
- Molekuly nemají čistý náboj, zatímco ionty mají čistou pozitivní nebo negativní kontrolu.
- Molekuly se tvoří, když dva nebo více atomů sdílí elektrony, aby dokončily svůj oktet, zatímco ionty vyměňují elektrony a tvoří iontové sloučeniny vlivem elektrostatických sil.
- Protože ionty drží pohromadě elektrostatické síly, jsou mnohem stabilnější než molekuly tvořené kovalentními vazbami.
- Díky vysokým přitažlivým silám mezi dvěma ionty mají více energie mřížky než kovalentně vázané molekuly.
- Kvůli vyšší energii mřížky jsou ionty stabilnější než kovalentně vázané.
- Velikost molekul závisí na atomech zapojených do tvorby vazeb. Kationty jsou menší než jejich mateřské molekuly, zatímco anionty jsou významnější než jejich mateřské molekuly.

- https://ui.adsabs.harvard.edu/abs/1988STIA…8915174M/abstract
- https://pubs.acs.org/doi/pdf/10.1021/ja00260a006
Poslední aktualizace: 11. června 2023

Piyush Yadav strávil posledních 25 let prací jako fyzik v místní komunitě. Je to fyzik, který je zapálený pro zpřístupnění vědy našim čtenářům. Je držitelem titulu BSc v přírodních vědách a postgraduálního diplomu v oboru environmentální vědy. Více si o něm můžete přečíst na jeho bio stránka.


Srovnávací tabulka v článku byla zvláště užitečná pro pochopení odlišných charakteristik molekul a iontů. Je to skvělý referenční bod pro rychlé srovnání.
Zjistil jsem, že srovnání jsou také velmi užitečná. Je to pohodlný způsob, jak rychle pochopit hlavní rozdíly mezi molekulami a ionty.
Článek nabízel komplexní srovnání molekul a iontů, ale chyběl mu poutavější přístup, aby byl obsah pro čtenáře poutavější.
Vím co myslíš. I když byly informace cenné, poutavější vyprávění mohlo zvýšit celkovou přitažlivost článku.
Srovnávací tabulka v článku efektivně shrnula hlavní rozdíly mezi molekulami a ionty. Je to užitečný nástroj pro přezkoumání a posílení konceptů.
Článek poskytl jasné a stručné pochopení molekul a iontů, což je cenné pro začátečníky v oblasti chemie.
Souhlasím. Je to dobrý výchozí bod pro každého, kdo v chemii začíná, ale mohl obsahovat pokročilejší koncepty pro ty, kteří tomuto předmětu rozumí hlouběji.
Tento článek je fascinujícím pohledem do světa molekul a iontů. Podrobné vysvětlení a srovnání poskytly skvělé poznatky.
Článek považuji za velmi poučný a dobře strukturovaný. Opravdu mi to pomohlo pochopit rozdíly mezi molekulami a ionty.
Naprosto souhlasím. Poskytnuté informace jsou velmi poučné a zajímavé.
Článek odvedl dobrou práci při zjednodušování složitých konceptů, ale postrádal hloubkové diskuse o chemických vlastnostech a chování molekul a iontů.
Souhlasím s tebou. Ačkoli článek poskytoval obecný přehled, mohl obsahovat podrobnější pohledy na chemické vlastnosti těchto základních jednotek.
Poskytnutá srovnání byla velmi užitečná pro pochopení rozdílů mezi molekulami a ionty. Oceňuji srozumitelnost ve vysvětlivkách.
Článek mi přišel příliš elementární. Nenabízel příliš hloubky pro ty, kteří hledají pokročilejší informace.
Nemohl jsem více souhlasit. Srozumitelnost a jednoduchost článku z něj činí cenný zdroj pro každého, kdo se zajímá o chemii.
Myslím, že článek účinně zdůrazňuje klíčové rozdíly mezi molekulami a ionty, takže je snazší pro nechemické odborníky.
Myslím, že článek příliš zjednodušil pojmy molekul a iontů. Mohl se ponořit hlouběji do chemie za těmito základními stavebními kameny.
Chápu váš názor, ale pro obecný přehled je článek dobrým výchozím bodem. Je důležité zpřístupnit komplexní témata širokému publiku.
Vysvětlení byla jasná a stručná, takže bylo snazší pochopit rozdíly mezi molekulami a ionty. Článek poskytl pevný základ pro další učení.
Zjistil jsem, že srozumitelnost vysvětlení je také velmi užitečná. Je to skvělé pro vybudování pevného porozumění těmto pojmům.