Nährstoffe in der Nahrung können vom Körper nicht sofort aufgenommen werden. Sie müssen durch verschiedene Enzyme in kleinere Teile zerlegt werden.
Im Fall von Proteinen helfen spezifische Enzyme, sie in Aminosäuren zu zerlegen, die der Körper verwendet. Diese Enzyme sind von zwei Arten, nämlich Chymotrypsin und Trypsin.
Key Take Away
- Chymotrypsin ist ein proteolytisches Enzym, das Peptidbindungen an aromatischen Aminosäuren spaltet.
- Trypsin ist ein weiteres proteolytisches Enzym, das auf Peptidbindungen an basischen Aminosäuren abzielt.
- Beide Enzyme spielen eine wesentliche Rolle bei der Proteinverdauung im Verdauungssystem.
Chymotrypsin gegen Trypsin
Chymotrypsin ist ein Verdauungsenzym, das Proteine in kleinere Peptide und Aminosäuren zerlegt. Trypsin spaltet Peptid Bindungen auf der Carboxylseite essentieller Aminosäuren. Trypsin wird in der Bauchspeicheldrüse produziert und ist wichtig für die Verdauung von Proteinen im Dünndarm.

Chymotrypsin ist ein Enzym, das den Verdauungsprozess wesentlich unterstützt, indem es Proteine abbaut. Es wird von der Bauchspeicheldrüse als Bestandteil des Pankreassaftes ausgeschieden.
Das Enzym wird durch seinen Vorläufer namens Chymotrypsinogen aktiviert. Dies ist ein inaktives Enzym, das nur in Gegenwart von Trypsin funktioniert.
Inzwischen ist Trypsin eine andere Art von Verdauungsenzym, das mit verschiedenen Aminosäuren arbeitet. Es wird auch von der Bauchspeicheldrüse produziert.
Der Großteil seiner Arbeit wird jedoch im Dünndarm verrichtet. Sein Vorläufer ist ein inaktives Enzym namens Trypsinogen. Das inaktive Enzym funktioniert nur in Gegenwart von Enterokinase.
Vergleichstabelle
| Vergleichsparameter | Chymotrypsin | Trypsin |
|---|---|---|
| Angewandte F&E | Es wurde in den 1900er Jahren entdeckt. | Es wurde 1876 entdeckt. |
| Bedeutung | Es ist ein Verdauungsenzym, das am Abbau aromatischer Aminosäuren arbeitet. | Es ist ein Verdauungsenzym, das am Abbau basischer Aminosäuren arbeitet. |
| Vorläufer | Sein Vorläufer ist ein inaktives Enzym namens Chymotrypsinogen. | Sein Vorläufer ist ein inaktives Enzym namens Trypsinogen. |
| Aktivierung | Seine Vorstufe wird mit Hilfe von Trypsin aktiviert. | Seine Vorstufe wird mit Hilfe von Enterokinase aktiviert. |
| Amino Acids | Es wählt Aminosäuren aus, darunter Tyrosin, Tryptophan und Phenylalanin. | Es wählt Aminosäuren einschließlich Arginin und Lysin aus. |
| Verwendung | Es kann für Peptidkartierung, Peptidsynthese, Analyse und sogar Fingerprinting verwendet werden. | Es kann zur Gewebedissoziation, mitochondrialen Isolierung und Zellernte verwendet werden. |
| Inhibitoren | Zu seinen Inhibitoren gehören Benzamidin, Aprotinin, DFP, EDTA, Ag+ usw. | Zu seinen Inhibitoren gehören Boronsäuren, Peptidylaldehyde, Cumarinderivate usw. |
Was ist Chymotrypsin?
Chymotrypsin ist ein Verdauungsenzym, das erstmals in den 1900er Jahren entdeckt wurde. Sie gehört zur Familie der Serinproteasen und fällt unter die Kategorie der Endopeptidasen.
Das Enzym hat a molekulare Masse von 25.6 kDa. Sein Vorläufer heißt Chymotrypsinogen. Dies ist ein inaktives Enzym, das mit Hilfe von Trypsin aktiviert wird.
Dabei wird Chymotrypsin gebildet und als Bestandteil des Pankreassaftes aus der Bauchspeicheldrüse freigesetzt.
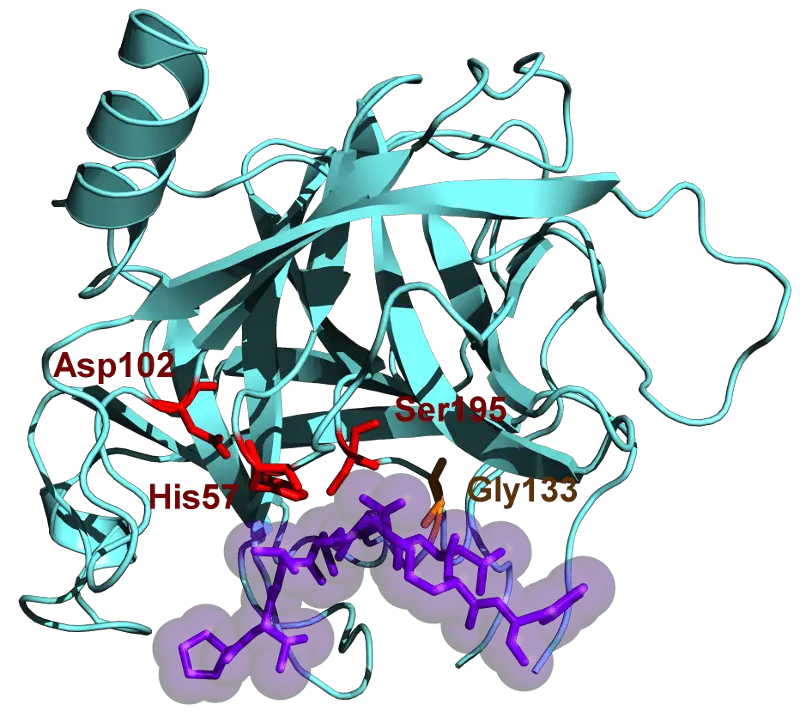
Jedes Enzym hat eine aktive Stelle im Inneren, die so gebaut ist, dass bestimmte Strukturen und Größen hineinpassen. Das bedeutet, dass das Enzym bestimmte Aminosäuren auswählen muss, die in sie passen.
Bei Chymotrypsin werden nur aromatische Aminosäuren ausgewählt.
Dazu gehören Tyrosin, Tryptophan und Phenylalanin. Sobald sie in das aktive Zentrum des Enzyms eintreten, werden ihre Peptidbindungen aufgebrochen, damit sie verdaut werden können.
Diese Enzyme dienen einer Vielzahl von Zwecken in medizinischen und Vito-Studien. Sie werden für die Peptidkartierung, Peptidsynthese, Analyse und sogar für das Fingerprinting verwendet.
Es gibt auch bestimmte Inhibitoren, die an Chymotrypsin binden, um seine Aktivität zu verringern. Dazu gehören Benzamidin, Aprotinin, DFP, EDTA, Ag+ usw.
Sie sind in Nahrungsergänzungsmitteln enthalten, die Menschen mit gestörten Chymotrypsin-Enzymen verschrieben werden.
Was ist Trypsin?
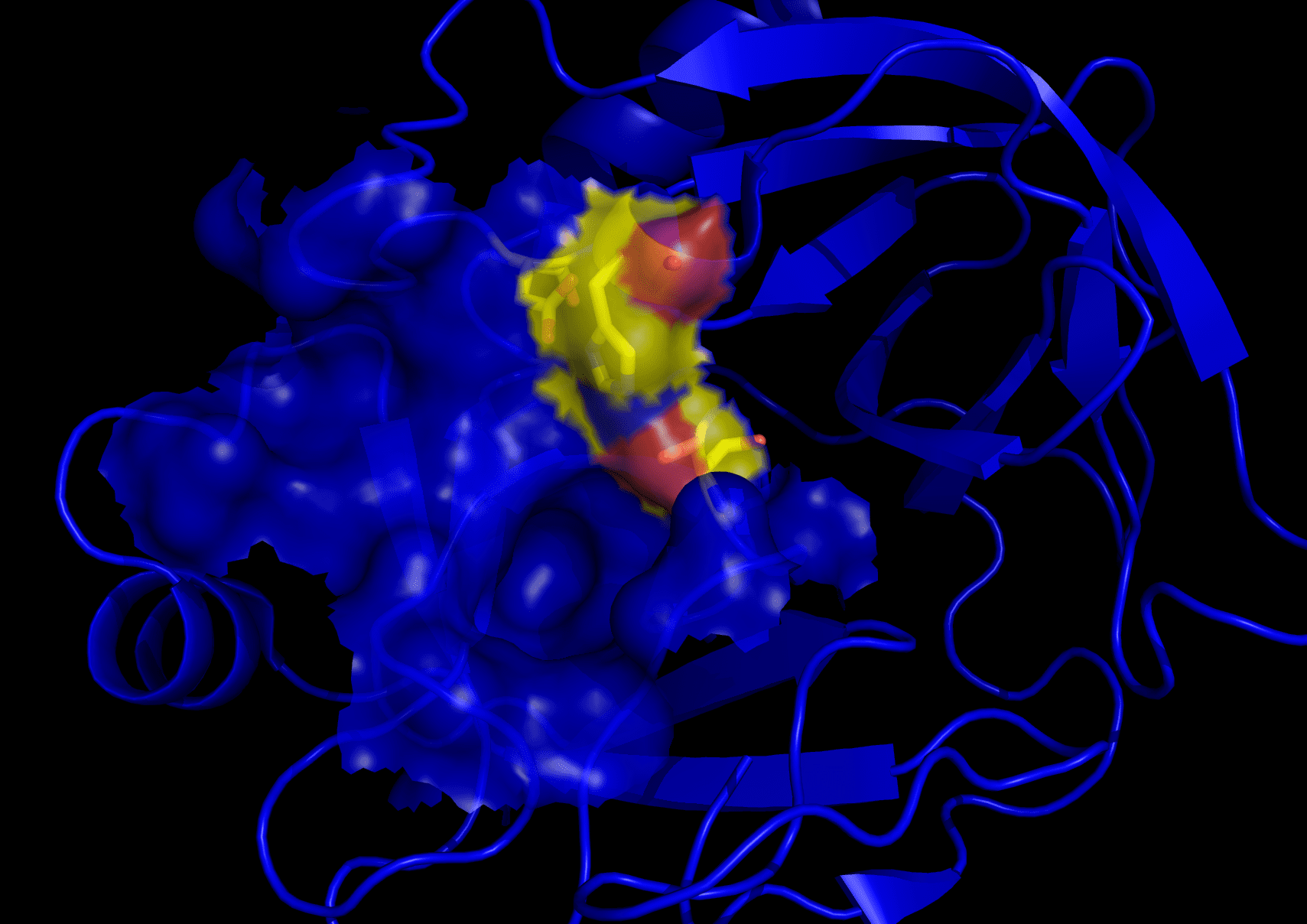
Trypsin ist ein weiteres Verdauungsenzym, das jedoch erst im Jahr 1876 entdeckt wurde. Es gehört ebenfalls zur Familie der Serinproteasen, fällt aber unter die Kategorie der globulären Proteine.
Die Molekülmasse von Trypsin beträgt 23.3 kDa. Seine Funktion besteht darin, Peptidbindungen in Aminosäuren aufzubrechen.
Das Enzym wird von der Bauchspeicheldrüse aus seinem Vorläufer namens Trypsinogen freigesetzt.
Dieses inaktive Enzym kommt zur Aktivierung mit Enterokinase in Kontakt. Sobald dies geschieht, wird es in den Dünndarm getragen, wo der größte Teil seiner Funktion stattfindet.
Das Enzym wählt nur bestimmte basische Aminosäuren in sein aktives Zentrum aus. Dazu gehören Arginin und Lysin.
Trypsin hat verschiedene Verwendungen bei der Gewebedissoziation, der mitochondrialen Isolierung und der Zellernte. Es hat auch mehrere Inhibitoren, darunter Boronsäuren, Peptidylaldehyde, Cumarinderivate usw.
Diese sind in verschiedenen Nahrungsergänzungsmitteln enthalten, die zahlreiche medizinische Anwendungen haben.
Trypsin besteht aus zwei Haupttypen. Dazu gehören Alpha-Trypsin und Beta-Trypsin. Jeder von ihnen hat eine andere Struktur und funktioniert bei einer anderen thermischen Stabilitätsschwelle.
Ihre beiden aktiven Zentren enthalten jedoch Asparaginsäure, Histidin und Serin, die den gesamten Prozess des Aufbrechens von Aminosäuren unterstützen. Sie tun dies, indem sie das c-terminale Ende spalten, an dem sich Kohlenstoff befindet.
Hauptunterschiede zwischen Chymotrypsin und Trypsin
- Chymotrypsin wurde in den 1900er Jahren entdeckt, während Trypsin 1876 entdeckt wurde.
- Chymotrypsin ist ein Verdauungsenzym, das aromatische Aminosäuren abbaut, während Trypsin ein Verdauungsenzym ist, das basische Aminosäuren abbaut.
- Chymotrypsin selektiert Aminosäuren, darunter Tyrosin, Tryptophan und Phenylalanin, während Trypsin Aminosäuren selektiert, darunter Arginin und Lysin.
- Das Vorläufer von Chymotrypsin ist ein inaktives Enzym namens Chymotrypsinogen, während das von Trypsin ein inaktives Enzym namens Trypsinogen ist.
- Die Vorstufe von Chymotrypsin wird mit Hilfe von Trypsin aktiviert, während die von Trypsin mit Hilfe von Enterokinase aktiviert wird.
- Chymotrypsin kann zur Peptidkartierung, Peptidsynthese, Analyse und sogar zum Fingerprinting verwendet werden, während Trypsin zur Gewebedissoziation, Mitochondrienisolierung und Zellernte verwendet werden kann.
- Chymotrypsin-Inhibitoren umfassen Benzamidin, Aprotinin, DFP, EDTA, Ag+ usw., während Trypsin-Inhibitoren Boronsäuren, Peptidylaldehyde, Cumarinderivate usw. umfassen.
- https://www.sciencedirect.com/science/article/pii/0022283672900289
- https://www.sciencedirect.com/science/article/pii/0014579395014845
Letzte Aktualisierung: 11. Juni 2023

Piyush Yadav hat die letzten 25 Jahre als Physiker in der örtlichen Gemeinde gearbeitet. Er ist ein Physiker, der sich leidenschaftlich dafür einsetzt, die Wissenschaft für unsere Leser zugänglicher zu machen. Er hat einen BSc in Naturwissenschaften und ein Postgraduiertendiplom in Umweltwissenschaften. Sie können mehr über ihn auf seinem lesen Bio-Seite.


Hervorragender detaillierter Vergleich der beiden Enzyme. Sehr informativ und gut geschrieben.
Ja, es ist ein sehr informativer Artikel. Gut erklärte Unterschiede zwischen den beiden Enzymen.
Ich habe dabei viel gelernt. Die präzisen Informationen erleichtern das Verständnis.
Dieser Artikel bietet einen großartigen Einblick in Chymotrypsin und Trypsin. Wirklich lehrreich.
Sehr gut recherchiert und informativ. Eine Pflichtlektüre für jeden, der sich für dieses Thema interessiert.
Ich fand diesen Artikel sehr aufschlussreich und klar. Ich hatte keine Ahnung, dass es einen solchen Unterschied zwischen diesen beiden Enzymen gibt.
Ich stimme zu, ein sehr gründlicher Vergleich zwischen Chymotrypsin und Trypsin.
Ja, die Präzision des Artikels macht ihn zu einer sehr informativen Lektüre.
Der detaillierte Vergleich dieser beiden Verdauungsenzyme ist faszinierend. Eine sehr aufschlussreiche Lektüre.
Die detaillierte Aufschlüsselung beider Enzyme ist sehr anschaulich und hilfreich!
Ich stimme zu, der Artikel ist gut strukturiert und leicht zu verstehen.
Ja, eine tolle Informationsquelle zu diesem Thema.
Ein gut recherchierter Text. Danke für das Teilen!
Vielen Dank für diesen umfassenden Einblick in die Unterschiede zwischen Chymotrypsin und Trypsin.