Wenn ein Element und eine Verbindung miteinander reagieren, findet eine chemische Reaktion statt. Und diese Reaktion bildet für sich genommen ein ganz neues Produkt.
Diese Reaktion verändert auch die Anordnung der Atome in jedem Element und der Verbindung.
Daher absorbiert es entweder die Energie oder gibt sie frei, und dies geschieht, um die Veränderungen herbeizuführen und die Reaktion in Gang zu setzen.
Basierend auf diesem gesamten Verfahren und Auftreten wird eine chemische Reaktion weiter in zwei Teile unterteilt – exotherme Reaktion und endotherme Reaktion.
Key Take Away
- Eine exotherme Reaktion ist eine chemische Reaktion, die Wärme an ihre Umgebung abgibt, während eine endotherme Reaktion eine chemische Reaktion ist, die Wärme aus ihrer Umgebung aufnimmt.
- Bei einer exothermen Reaktion liegt die während der Reaktion freigesetzte Energie hauptsächlich in Form von Wärme und Licht vor, während bei einer endothermen Reaktion die absorbierte Energie hauptsächlich in Form von Wärme vorliegt.
- Die Verbrennung von Brennstoffen ist ein Beispiel für eine exotherme Reaktion, während die Photosynthese ein Beispiel für eine endotherme Reaktion ist.
Exotherme vs. endotherme Reaktion
Der Unterschied zwischen exothermen und endothermen Reaktionen besteht darin, dass eine endotherme Reaktion Energie in Form von Wärme absorbiert, die aus der Umgebung selbst aufgenommen wird, während eine exotherme Reaktion die Energie hingegen an die Umgebung abgibt. Ein Beispiel für eine exotherme Reaktion kann die Atmung sein, während ein Beispiel für eine endotherme Reaktion das Schmelzen von Eis ist.

Eine exotherme Reaktion ist eine Form einer chemischen Reaktion, die bei ihrem Auftreten Energie in die Umgebung freisetzt.
Die Energie, die bei der exothermen Reaktion freigesetzt wird, ist mehr als die Energie, die benötigt wird, um die gesamte chemische Reaktion zu starten oder sogar durchzuführen.
Die Energie, die an die Umgebung abgegeben wird, liegt im Wesentlichen in Form von Wärme oder Licht vor.
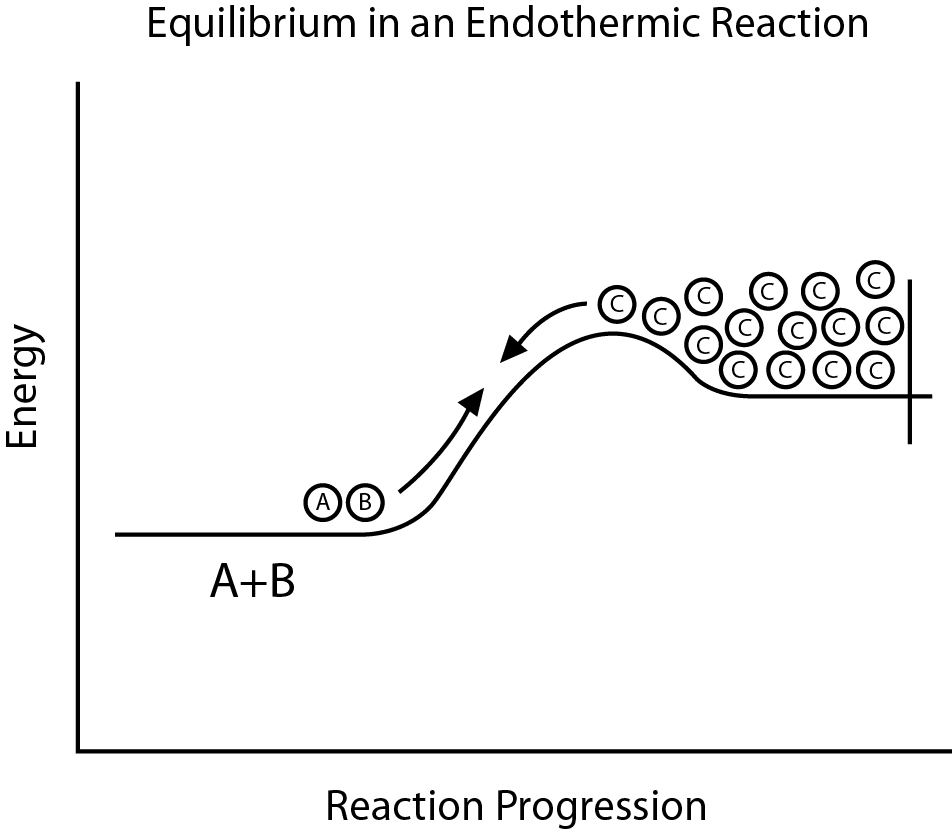
Es gibt zwei verschiedene Arten von chemischen Reaktionen, und eine davon ist die endotherme Reaktion, bei der die Reaktanten die Teil dieser chemischen Reaktion sind, nehmen Energie aus der Umgebung auf, um die Reaktion durchzuführen, und diese Energie liegt ausschließlich in Form von Wärme vor. Die Temperatur der Umgebung wird abgekühlt, wenn eine endotherme Reaktion stattfindet. Die exotherme Reaktion ist das Gegenteil der endothermen Reaktion.
Beide sind Teil einer chemischen Reaktion.
Vergleichstabelle
| Vergleichsparameter | Exotherme Reaktion | Endotherme Reaktion |
|---|---|---|
| Definition | Exotherme Reaktionen sind solche Reaktionen, bei denen die Energie an die Umgebung abgegeben wird. Wenn ein Prozess eine Erwärmung erfordert, sollten die anderen die Wärme abgeben, wenn sie stattfinden. Diese werden als exotherm bezeichnet. | Endotherme Reaktionen sind Reaktionen, bei denen Energie aus der Umgebung aufgenommen wird. Eine endotherme Reaktion ist ein Teil einer chemischen Reaktion, die in der Umgebung stattfindet. |
| Enthalpie | Bei einer exothermen Reaktion ist die Enthalpieänderung negativ. | Bei einer endothermen Reaktion ist die Enthalpieänderung positiv. |
| Energieform | Bei einer exothermen Reaktion wird Energie in vielen Formen freigesetzt, z. B. Wärme, Licht, Elektrizität usw. | Bei einer endothermen Reaktion wird Energie nur in Form von Wärme freigesetzt. |
| Beispiel | Atmung. | Schmelzen von Eis. |
| Energie | In einer endothermen Reaktion wird Energie in beliebiger Form an die Umgebung abgegeben. | In einer endothermen Reaktion wird Energie aus der Umgebung aufgenommen. |
Was ist eine exotherme Reaktion?
Die exotherme Reaktion gibt die gesamte Wärme an die Umgebung ab und ersetzt gleichzeitig die schwachen Bindungen durch die stärkeren.
Es gibt eine andere Reaktionsform, die benannt wird exergonisch Reaktion, mit der auch die exotherme Reaktion verwechselt wird. Allerdings kann eine sehr starke exotherme Reaktion als exergonisch bezeichnet werden, allerdings nicht immer.
Wenn ein Prozess Wärme benötigt, sollten die anderen die Wärme abgeben, wenn sie stattfinden. Diese werden als exotherm bezeichnet.
Beispielsweise kondensiert Dampf, der nichts anderes als die gasförmige Form von Wasser ist, und Wärme wird an die Umgebung abgegeben. Ebenso wird beim Gefrieren von Wasser in flüssiger Form Wärme an die Umgebung abgegeben.
Das flüssige Wasser musste Energie abgeben, um zu Dampf zu werden, aber diese Energie geht überhaupt nicht in der Umgebung verloren.

Was ist eine endotherme Reaktion?
Eine Enthalpieerhöhung ist nichts anderes als eine endotherme Reaktion eines Systems. Eine endotherme Reaktion ist Teil einer chemischen Reaktion, die in der Umwelt stattfindet.
Apropos geschlossenes System: Was die Reaktion in der Umgebung auslöst, ist die Absorption Wärmeenergie aus seiner Umgebung, die eigentlich nichts als Wärme ist, die während des Prozesses in dasselbe System der Reaktion übertragen wird.
Wenn eine endotherme Reaktion stattfindet, kühlt sich die Umgebung ab, und zwar aus dem Grund, dass bei der Reaktion Wärmeenergie absorbiert wird.
Eine endotherme Reaktion ist keine große oder außergewöhnliche Reaktion. Tatsächlich kann es sich auch um einen einfachen chemischen Prozess handeln, zum Beispiel das Auflösen von Ammoniumnitrat in Wasser, oder sogar um jeden physikalischen Prozess, der die Freisetzung von Wärme erfordert, wie das Schmelzen von Eis. Beide sind Teile einer chemischen Reaktion. Daher hängt in jedem dieser Begriffe das Präfix des Wortes von der Hitze ab, ob sie austritt oder freigesetzt wird.
Hauptunterschiede zwischen exothermer und endothermer Reaktion
- Der Hauptunterschied zwischen exothermen und endothermen Reaktionen besteht darin, dass exotherme Reaktionen solche Reaktionen sind, die bei ihrem Auftreten Energie in der Umgebung freisetzen, während endotherme Reaktionen andererseits solche sind, die zur Durchführung Energie aus ihrer Umgebung absorbieren.
- Bei einer exothermen Reaktion ist die Enthalpieänderung negativ, bei einer endothermen Reaktion ist die Enthalpieänderung positiv.
- Bei einer exothermen Reaktion kann Energie in beliebiger Form freigesetzt werden, sagen wir Wärme, Licht, Elektrizität usw. Bei einer endothermen Reaktion wird Energie jedoch nur in einer einzigen Form freigesetzt, und zwar in Form von Erwärmung.
- Ein Beispiel für eine exotherme Reaktion wäre die Atmung, während ein Beispiel für eine endotherme Reaktion das Schmelzen von Eis wäre.
- Bei einer endothermen Reaktion wird Energie an die Umgebung abgegeben, während bei einer endothermen Reaktion Energie aus der Umgebung absorbiert wird.
- https://www.nature.com/articles/s41563-020-00851-x
- https://www.sciencedirect.com/science/article/pii/0010218080900176
Letzte Aktualisierung: 15. August 2023

Piyush Yadav hat die letzten 25 Jahre als Physiker in der örtlichen Gemeinde gearbeitet. Er ist ein Physiker, der sich leidenschaftlich dafür einsetzt, die Wissenschaft für unsere Leser zugänglicher zu machen. Er hat einen BSc in Naturwissenschaften und ein Postgraduiertendiplom in Umweltwissenschaften. Sie können mehr über ihn auf seinem lesen Bio-Seite.


Die ausführliche Erläuterung exothermer und endothermer Reaktionen im Artikel ist für Studierende und alle, die sich für Chemie interessieren, von Nutzen.
Ich fand den Inhalt gut strukturiert und informativ und vermittelte ein klares Verständnis dafür, wie diese Reaktionen ablaufen.
Der Artikel erklärt das Konzept der exothermen und endothermen Reaktionen sehr klar und prägnant. Es ist eine großartige Ressource für alle, die diese Konzepte eingehend verstehen möchten.
Es bietet sicherlich eine solide Grundlage für das Verständnis dieser grundlegenden chemischen Reaktionen.
In diesem Artikel werden die Konzepte exothermer und endothermer Reaktionen effektiv erläutert, indem er klare Beispiele und einen gründlichen Vergleich ihrer Eigenschaften liefert.
Der Artikel ist eine wertvolle Ressource für ein tieferes Verständnis exothermer und endothermer Reaktionen in der Chemie.
Es ist ein gut geschriebener Artikel, der sich mit der Komplexität exothermer und endothermer Reaktionen befasst, was ihn zu einer spannenden Lektüre macht.
Der Artikel bietet einen umfassenden Überblick über exotherme und endotherme Reaktionen und fördert das Verständnis des Lesers für die komplexen Prozesse chemischer Reaktionen.
Ich fand die Beispiele exothermer und endothermer Reaktionen besonders hilfreich, um die Unterschiede zwischen den beiden zu verdeutlichen.
Die detaillierten Beispiele und die Vergleichstabelle machen die Unterschiede zwischen exothermen und endothermen Reaktionen sehr deutlich und ermöglichen ein besseres Verständnis ihrer Eigenschaften.
Die im Artikel bereitgestellten praktischen Beispiele unterstützen ein umfassendes Verständnis exothermer und endothermer Reaktionen.
Der logische Ablauf des Artikels trägt dazu bei, die Schlüsselkonzepte, die exothermen und endothermen Reaktionen zugrunde liegen, prägnant darzustellen.
Ich schätze den gründlichen Vergleich zwischen exothermen und endothermen Reaktionen, der es einfacher macht, die Unterschiede und Anwendungen der einzelnen Reaktionstypen zu verstehen.
Der Artikel erfasst wirkungsvoll das Wesen exothermer und endothermer Reaktionen und liefert wertvolle Einblicke in ihre Bedeutung.
Der Artikel geht hervorragend auf exotherme und endotherme Reaktionen ein und hebt deren Bedeutung für das Verständnis chemischer Prozesse hervor.
Ein sehr interessanter Artikel, der die Unterschiede zwischen exothermen und endothermen Reaktionen erklärt und erklärt, wie chemische Reaktionen ablaufen. Die bereitgestellten Beispiele sind sehr anschaulich.
Es hat mir Spaß gemacht, diesen Artikel zu lesen, er ist eine großartige Auffrischung der Grundprinzipien der Chemie.
Ich stimme zu, es ist eine sehr umfassende und aufschlussreiche Erklärung.
Dieser Artikel bietet eine aufschlussreiche Untersuchung exothermer und endothermer Reaktionen und trägt zu einem tieferen Verständnis dieser grundlegenden chemischen Phänomene bei.
Die umfassende Berichterstattung des Artikels über exotherme und endotherme Reaktionen ermöglicht es den Lesern, die Komplexität chemischer Reaktionen besser zu erfassen.
Der Artikel bietet eine gut organisierte und aufschlussreiche Erklärung exothermer und endothermer Reaktionen und bietet eine wertvolle Lernerfahrung.
Die eingehende Analyse der thermischen Energieübertragung bei exothermen und endothermen Reaktionen trägt wesentlich zum Verständnis dieser grundlegenden chemischen Prozesse bei.