Kahdenlaisia reaktioita kuvataan sanoilla endergonic ja exergonic. Monia kemiallisia ja biologisia vuorovaikutuksia tapahtuu jatkuvasti sekä ihmiskehon sisällä että sen ulkopuolella.
Tässä artikkelissa käytetään kuvaavaa taulukkoa erottamaan perustavanlaatuiset ja edistyneet erot näiden kahden reaktion välillä, jotta aloittelija ja kemian harrastaja olisi helpompi oppia ja ymmärtää.
Keskeiset ostokset
- Eksergoniset reaktiot vapauttavat energiaa, kun taas endergoniset reaktiot absorboivat energiaa ympäristöstään.
- Eksergonisilla reaktioilla on negatiivinen Gibbsin vapaan energian muutos, kun taas endergonisilla reaktioilla on positiivinen muutos.
- Endergoniset reaktiot ovat ei-spontaaneja, kun taas eksergoniset reaktiot ovat spontaaneja tietyissä olosuhteissa.
Eksergoniset reaktiot vs endergoniset reaktiot
Ekserginen Reaktiot ovat kemiallisia reaktioita, joissa vapaan energian muutos on negatiivinen tai vapaata energiaa nettovapautuu ja se osoittaa spontaanin reaktion. Endergoniset reaktiot ovat reaktioita, joissa vapaan energian standardimuutos on positiivinen, ja tämän suorittamiseen tarvitaan liikkeellepaneva voima.

Reaktio, joka tuottaa vapaata energiaa, tunnetaan "eksergonisena" reaktiona. Koska tämä reaktio tuottaa energiaa sen sijaan, että se kuluttaa sitä, se voi tapahtua itsestään, ilman muiden voimien väliintuloa.
Eksergoniset reaktiot biokemiassa sekä lämpökemiassa ovat sellaisia, joissa vapaan energian muutos on negatiivinen (miinus numeerisena arvona).
Nämä eivät ole tahattomia reaktioita, jotka eivät ole spontaaneja. Aloittaakseen he tarvitsevat rasitusta tai voimansyöttöä – pääasiassa energian muodossa.
Endergonisen reaktion yleinen tehtävä on vapauttaa energiaa hiilihydraattimolekyyleistä tai mistä tahansa oletetusta ruokamolekyyleistä, jolloin otukset voivat menestyä ilman, että ne tarvitsevat energiaa pelkästään auringonvalosta.
Vertailu Taulukko
| Vertailun parametrit | Eksergoniset reaktiot | Endergoniset reaktiot |
|---|---|---|
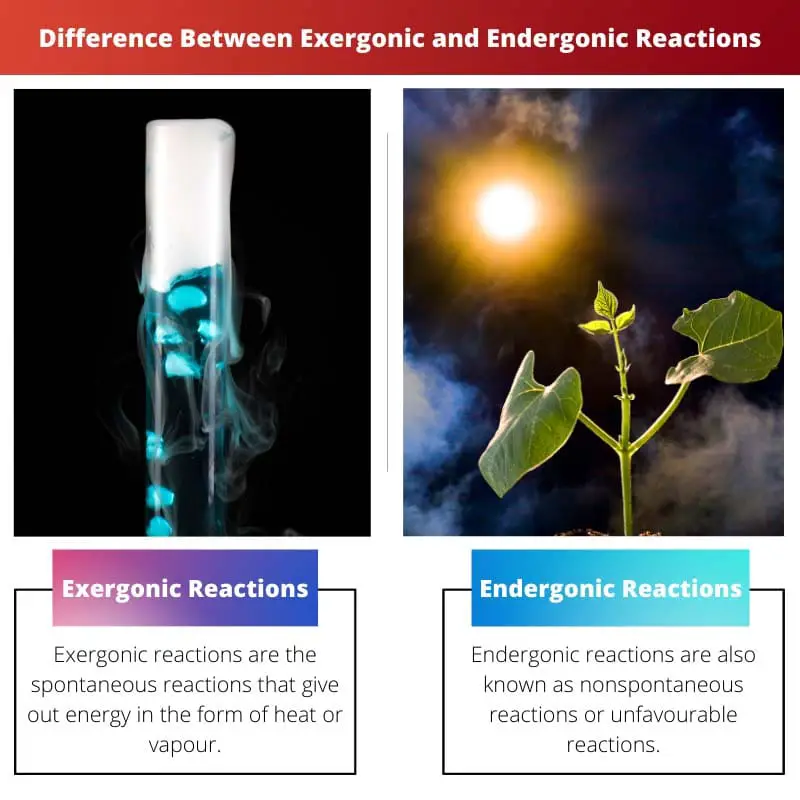
| Määritelmä | Eksergoniset reaktiot ovat spontaaneja reaktioita, jotka luovuttavat energiaa lämmön tai höyryn muodossa. | Endergoniset reaktiot tunnetaan myös ei-spontaanien reaktioiden tai epäsuotuisten reaktioiden nimissä. Reaktio vaatii enemmän energiaa kuin saat |
| Gibbsin ilmaista energiaa | Gibbsin vapaan energian arvo on negatiivinen. | Gibbs Free Energyn arvo on positiivinen. |
| Entropiataso | Entropiataso kasvaa tyypillisessä eksergonisessa reaktiossa. | Entropia vähenee endergonisessa reaktiossa. |
| Energiatarve | Antaa energiaa lämmön muodossa. | Ottaa energiaa ympäristön kautta reaktion käynnistämiseksi tai jatkamiseksi. |
| Esimerkit | Natriumin ja kloorin reaktio ruokasuolan muodostamiseksi, palaminen ja kemiluminesenssi. Tässä reaktiossa energiaa vapautuu valon muodossa. | Fotosynteesin kemiallinen reaktio on hyvä esimerkki endergonisista reaktioista. |
Mitä ovat eksergoniset reaktiot?
Eksergoniset ovat peruuttamattomia reaktioita, joita esiintyy luonnossa ympäristössä. Termi "spontaani" viittaa johonkin, joka on valmis tai innokas tapahtumaan ilman ulkoista stimulaatiota tai vain vähän.
Esimerkiksi natrium palaa ilmakehän hapen vaikutuksesta. Toinen esimerkki eksergonisista reaktioista on puun savuttaminen.
Normaalilämpötilassa ja -paineessa Gibbsin vapaa energia on nolla, mikä osoittaa, että lämpöä otetaan enemmän kuin absorboidaan. Nämä ovat vastauksia, joita ei voi peruuttaa.
Elävät organismit käyttävät eksergonisia prosesseja kuljettaakseen energiaa "varastosta" yhdessä komponentissa, kuten rasvassa tai sokerissa, aktivoituun tilaan, kuten ATP:hen.
Mikä on endergoninen reaktio?
Prosessi, jossa lämpö tai mikä tahansa energian muoto absorboituu, tunnetaan endergonisena reaktiona. Tämä tarkoittaa, että vapaan energian kokonaismuutos on kemiallisesti positiivinen.
Monet prosessit luonnossa voivat tapahtua vain, jos ympäristöstä on saatavilla riittävästi energiaa.
Ulkoinen energia auttaa liukeneminen näistä yhteyksistä. Sidosten katkeamisen seurauksena vapautuva energia ruokkii sitten reaktiota.
Endergonisten reaktioiden tapauksessa tämä Gibbsin vapaa energia on positiivinen (+), mikä osoittaa, että reaktio ei ole spontaani.
Tärkeimmät erot eksergonisten ja endergonisten reaktioiden välillä
- Eksergonisissa reaktioissa entropia kasvaa, kun taas endergonisissa reaktioissa entropia pienenee.
- Eksergonisten reaktioiden tuotteiden energia on enemmän kuin lähtöaineiden, kun taas tuotteiden energia on pienempi kuin lähtöaineiden energia endergonisissa reaktioissa.
- https://www.khanacademy.org/science/biology/energy-and-enzymes/free-energy-tutorial/a/gibbs-free-energy
- https://bio.libretexts.org/Bookshelves/Introductory_and_General_Biology/Book%3A_General_Biology_(Boundless)/6%3A_Metabolism/6.2%3A_Potential_Kinetic_Free_and_Activation_Energy/6.2A%3A__Free_Energy
Viimeksi päivitetty: 07. syyskuuta 2023

Piyush Yadav on työskennellyt viimeiset 25 vuotta fyysikkona paikallisessa yhteisössä. Hän on fyysikko, joka haluaa tehdä tieteen helpommin lukijoidemme ulottuville. Hän on koulutukseltaan luonnontieteiden kandidaatti ja ympäristötieteiden jatkotutkinto. Voit lukea hänestä lisää hänen sivuiltaan bio-sivu.


Tämä artikkeli esittää perusteellisen analyysin eksergonisista ja endergonisista reaktioista ja valaisee niiden merkitystä kemiallisissa ja biologisissa vuorovaikutuksissa.
Tämä artikkeli tarjoaa oivaltavan ja kattavan selityksen eksergonisista ja endergonisista reaktioista. Vertailutaulukko ja esimerkit ovat erityisen hyödyllisiä keskeisten erojen ymmärtämisessä.
Artikkeli on erittäin informatiivinen ja hyvin jäsennelty. Selkeä ero eksergonisten ja endergonisten reaktioiden välillä helpottaa lukijoiden ymmärtämistä käsitteistä.
Artikkelin selostus eksergonisista ja endergonisista reaktioista on kiitettävää, ja se tarjoaa lukijoille asiantuntevaa ymmärrystä niiden hallitsemista kemiallisista ja biologisista prosesseista.
Artikkeli selittää taitavasti eksergonisten ja endergonisten reaktioiden välisen kaksijakoisuuden ja havainnollistaa niiden vaikutuksia erilaisiin luonnonilmiöihin.
Artikkelin selitys eksergonisista ja endergonisista reaktioista on hyvin selkeä ja opettavainen. Esitetyt tosielämän esimerkit toimivat käytännöllisinä havainnollisina ja auttavat ymmärtämään paremmin käsitettä.
Kattava vertailu eksergonisten ja endergonisten reaktioiden välillä on kiitettävää, ja se selventää ydinerot tarkasti ja selkeästi.
Yksityiskohtainen vertailutaulukko korostaa tehokkaasti eksergonisten ja endergonisten reaktioiden välisiä perustavanlaatuisia eroja, ja se palvelee lukijoita, joilla on vaihteleva asiantuntemus. Kuvaavien esimerkkien käyttö lisää ymmärrystä entisestään.