Le tableau périodique de la chimie est quelque chose que les étudiants sont invités à mémoriser fastidieusement sans même connaître le motif réel de son apprentissage. Pour certaines personnes, c'est juste un sujet inclus dans leur programme.
Mais dans un sens réel, ce petit tableau périodique est bien plus important que cela ; c'est une feuille de route qui ouvre un million d'opportunités pour les scientifiques et les chercheurs du monde entier. Dmitri Mendeleïev est l'inventeur du tableau périodique.
Avant lui, beaucoup se sont efforcés d'organiser les éléments chimiques de différentes manières. Mais le résultat de Dmitri a été accepté dans le monde entier.
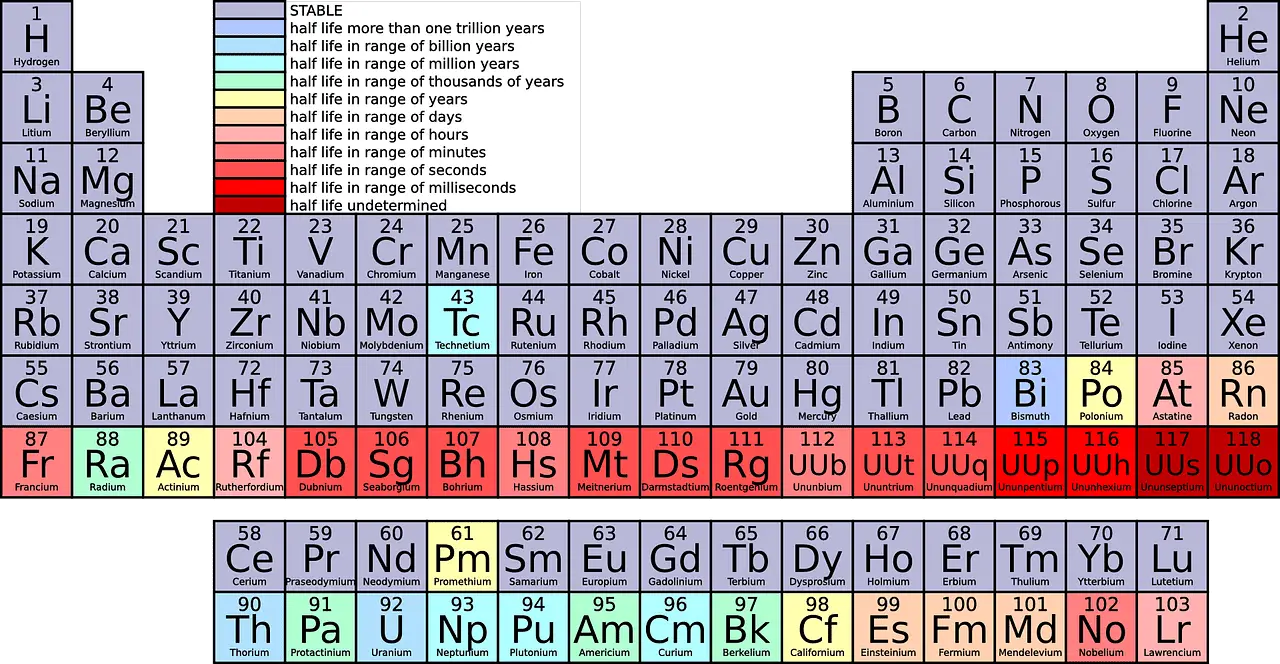
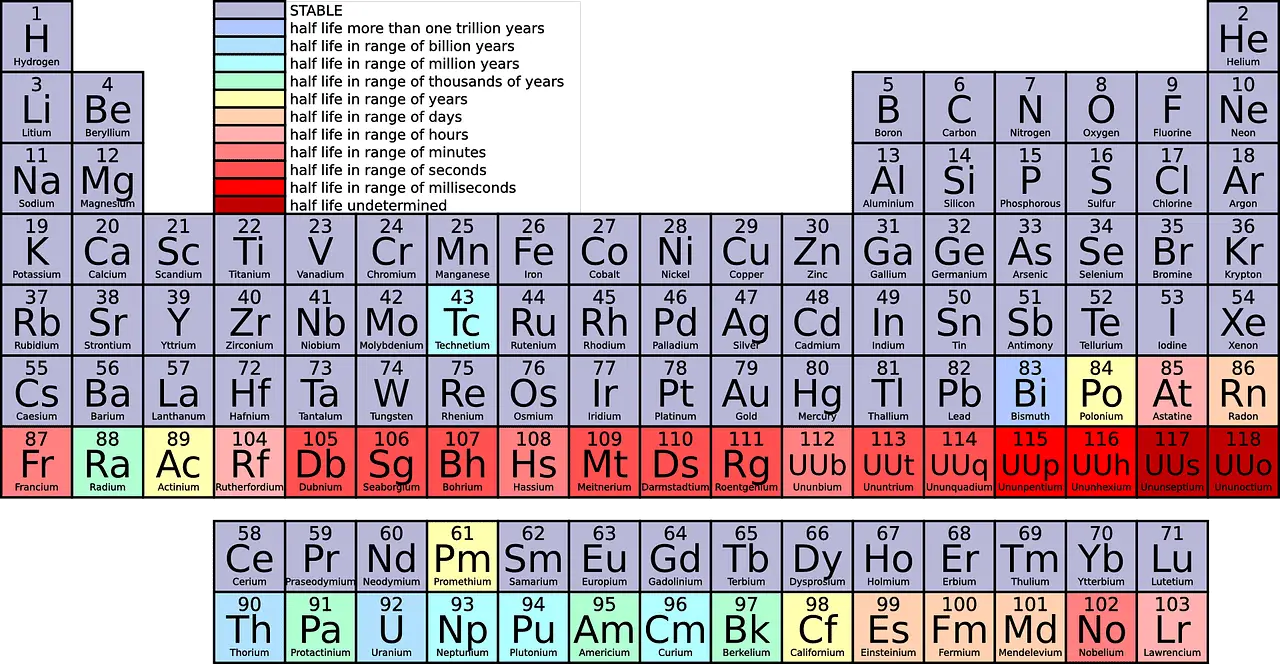
Dans les abréviations scientifiques, les lignes sont respectivement appelées Périodes et les colonnes Groupes.
Faits marquants
- Les périodes sont les lignes horizontales du tableau périodique, indiquant le nombre de couches d'électrons dans les atomes d'un élément, les éléments de la même période ayant des structures atomiques similaires.
- Les groupes sont les colonnes verticales du tableau périodique, constitués d'éléments avec le même nombre d'électrons dans leur enveloppe externe, ce qui conduit à des propriétés chimiques similaires.
- Les périodes et les groupes organisent les éléments du tableau périodique, avec des périodes représentant des lignes horizontales basées sur des couches d'électrons et des groupes représentant des colonnes verticales basées sur des électrons de la couche externe et des propriétés chimiques.
Période vs Groupe
Une période est une ligne horizontale qui va du côté gauche au côté droit du tableau périodique, et l'électronégativité augmente à travers elle. Un groupe est une verticale colonne qui va du haut du tableau périodique vers le bas, et l'électronégativité augmente de bas en haut.

Pendant le temps de l'arrangement, Mendeleïev a laissé quelques rangées vides avec l'impression que d'autres éléments entreraient dans un futur proche. Et étonnamment, l'un des éléments qui correspondaient à cet écart était Gallium.
Tableau de comparaison
| Paramètre de comparaison | Période | Réservation de groupe |
|---|---|---|
| Direction | Les périodes sont les lignes horizontales du tableau périodique moderne | Les groupes sont les colonnes verticales qui traversent le haut du tableau périodique |
| biens | Les éléments d'une période n'ont pas les mêmes propriétés. | Les éléments de chaque groupe ont des propriétés similaires mais pas des propriétés identiques. |
| Similitude | Les éléments de la même période ont un nombre égal de composition électronique | Les éléments de chaque groupe ont un nombre égal d'électrons de valence |
| Somme | Il y a 7 périodes dans le tableau périodique | Le groupe contient 18 éléments disposés verticalement dans le tableau périodique moderne. |
| Électronégativité | Il augmente de gauche à droite. | Il augmente de bas en haut dans un groupe. |
Qu'est-ce que la période ?
Une période est une ligne horizontale allant de l'extrême gauche à l'extrême droite du tableau périodique. A partir de maintenant, il y a 7 périodes sur le tableau périodique.
Une nouvelle période commence lorsqu'un nouveau niveau d'énergie fondamentale s'ajoute aux électrons. Chaque élément d'une période aura probablement un nombre égal d'orbitales atomiques.
Par exemple – chaque élément du 1st la période n'a que 1 orbital pour ses électrons, 2nd période comprend 2 orbitales pour les électrons. De même, les orbitales continuent de s'additionner au fur et à mesure que vous descendez dans la rangée.
La taille de l'élément diminue au fur et à mesure que vous vous déplacez sur une période car le nombre de couches d'électrons reste constant, mais le nombre de protons augmente dans le noyau. C'est pourquoi l'atome devient plus lourd, mais sa taille ne cesse de diminuer.
En regardant le tableau périodique, vous verriez différents éléments montés dans chaque ligne. La 1ère période a seulement 2 éléments (1 & 18), les 2ème et 3ème périodes ont 8 éléments chacune, les 4ème et 5ème périodes ont 18 éléments, et les 6ème et 7ème périodes ont 32 éléments chacune, respectivement.
Qu'est-ce que le groupe ?
En comptant de haut en bas, il y a 18 groupes dans le tableau périodique. Tous les groupes se voient attribuer des noms distincts.
Les groupes sont des catégories mixtes de métaux, de non-métaux et de semi-métaux, regroupés en familles selon leurs propriétés similaires. Par exemple, le groupe 1 appartient à la famille du lithium, classé comme métaux alcènes.
De même, chaque groupe de la voie a son nom de famille. Les éléments du groupe apparenté ont des traits similaires car ils ont le même nombre d'électrons dans leurs coquilles les plus externes.
La taille de l'élément augmente à mesure que vous déplacez un groupe vers le bas. En effet, un grand nombre de protons et de neutrons existent dans le noyau.
En plus de cela, une couche d'électrons supplémentaire rend l'atome plus lourd. Pour les groupes, il existe deux manières différentes d'illustrer les éléments.
Comprendre les deux systèmes de numérotation est essentiel car le tableau périodique apparaît dans les deux formats. Aux États-Unis, ils utilisaient les lettres A&B pour indiquer chaque élément du groupe, mais malheureusement, cela a été observé comme un système de numérotation désorganisé.
Pour éliminer toute confusion possible, l'International syndicat of Pure and Applied Chemistry (IUPAC) A eu l'idée de numéroter les éléments comme (1,2, 3… 18). Cependant, les deux systèmes de numérotation sont acceptables. Mais la numérotation de l'IUPAC semble bien organisée et simple.
Principales différences entre Période et Groupe
- Lieu: Les groupes sont la colonne verticale, tandis que les périodes sont les lignes droites du tableau périodique.
- Téléphone: Il y a un nombre total de 18 groupes et 7 périodes dans le tableau périodique, parmi lesquels les groupes sont classés en différentes familles et types de métaux.
- Propriétés chimiques: Tous les éléments du groupe ont des propriétés chimiques ou physiques analogues, tandis que les périodes partagent la même hiérarchie électronique.
- Niveau d'énergie: Au fur et à mesure que nous descendons le groupe de haut en bas, le niveau d'énergie des électrons augmente. En revanche, à chaque période, le niveau d'énergie de l'électron reste le même.
- Électronégativité : Cela diminue de haut en bas dans un groupe et augmente de gauche à droite dans une période. C'est une considération essentielle lors de l'étude du tableau périodique.

Dernière mise à jour : 11 juin 2023

Piyush Yadav a passé les 25 dernières années à travailler comme physicien dans la communauté locale. C'est un physicien passionné par l'idée de rendre la science plus accessible à nos lecteurs. Il est titulaire d'un baccalauréat en sciences naturelles et d'un diplôme d'études supérieures en sciences de l'environnement. Vous pouvez en savoir plus sur lui sur son page bio.

Excellent article! Cela donne un bon aperçu de l’importance du tableau périodique. J'ai vraiment apprécié ça!
Je suis très heureux que vous l'ayez trouvé utile. Je l'ai fait aussi!
Absolument, tous les étudiants en sciences devraient lire ceci.
Article très instructif. Nous devrions faire pression pour une meilleure éducation et une meilleure compréhension des sujets scientifiques.
C'est exactement ce dont nous avons besoin.
Ceci n’est qu’un autre exemple de normes éducatives dépassées. Nous devrions enseigner des sujets plus pertinents aux étudiants.
Je crois qu'il est d'une importance vitale que les étudiants comprennent le tableau périodique.
C'est une vision controversée, Joel.
Je pense que les gens sous-estiment la valeur du tableau périodique. Nous devrions faire davantage pour améliorer notre enseignement à ce sujet.
Absolument, c'est un point important.
Je pense qu'il est vraiment intéressant qu'un tableau aussi simple en apparence puisse contenir autant d'informations précieuses.
Oui, c'est assez fascinant.
C’est éclairant. Le tableau périodique est sous-estimé.
C'était une lecture indispensable pour commencer ma journée !
Quelques points valables présentés ici, mais je ne suis toujours pas convaincu de l'importance du tableau périodique.
Je suis d'accord avec toi, Zach.
Le tableau périodique est la pierre angulaire de la chimie et doit être traité comme tel.
Je ne pourrais pas être plus d'accord.
Je ne suis pas d'accord, je pense que l'enseignement du tableau périodique de la manière actuelle est dépassé et devrait être révisé.
Je comprends pourquoi certains pourraient le trouver obsolète, mais il est réellement vital pour le développement scientifique.
Je peux voir ce que vous dites mais je ne suis pas entièrement d'accord.
Même si je comprends l'importance du tableau périodique, il est difficile de prétendre que le système éducatif actuel est adéquat.
Vous soulevez un point important, Erin.