Le celle galvaniche o elettrolitiche sono uno dei componenti più importanti, estremamente necessari nell'industria dei semiconduttori e non solo.
Le celle galvaniche sono utilizzate nelle batterie per aiutarci ad alimentare apparecchi di ogni dimensione, mentre le celle elettrolitiche sono utilizzate principalmente per la galvanica. Il meccanismo e l'output di entrambe le celle sono diversi.
Punti chiave
- Le celle galvaniche generano energia elettrica attraverso reazioni redox spontanee, mentre le celle elettrolitiche consumano energia elettrica per guidare reazioni non spontanee.
- Nelle celle galvaniche, l'anodo è il sito di ossidazione e il catodo è il sito di riduzione; nelle celle elettrolitiche, l'anodo è dove si verifica la riduzione e il catodo è dove si verifica l'ossidazione.
- Le celle galvaniche sono comunemente utilizzate nelle batterie, mentre le celle elettrolitiche sono impiegate in processi come la galvanica e l'elettrolisi.
Celle Galvaniche vs Celle Elettrolitiche
Le celle galvaniche generano energia elettrica da una reazione redox spontanea tra due elettrodi metallici, creando un flusso di elettroni per produrre energia elettrica. Le celle elettrolitiche utilizzano l'energia elettrica per guidare una reazione redox non spontanea, producendo metalli, metalli purificanti e metalli placcati.

Le celle galvaniche sono anche conosciute come celle elettrochimiche in cui avviene una reazione spontanea per produrre elettricità.
Le celle galvaniche sono costituite da due mezze celle che vengono poste in contenitori diversi e sono collegate da un sale Ponte dei lucchetti o una partizione porosa.
Le celle elettrolitiche possono essere descritte come l'opposto delle celle galvaniche in quanto convertono l'energia elettrica in energia chimica.
Nelle reazioni complessive, l'energia di Gibbs è positiva e quindi le reazioni redox non spontanee avvengono in una cella elettrolitica.
Tavola di comparazione
| Parametri di confronto | Celle galvaniche | Celle Elettrolitiche |
|---|---|---|
| Definizione | Le celle galvaniche sono celle elettrochimiche in grado di produrre elettricità. | Le celle elettrolitiche sono anche celle elettrochimiche ma usano l'energia elettrica per facilitare le reazioni chimiche. |
| Conversione | Le celle galvaniche convertono l'energia chimica in energia elettrica. | Le celle elettrolitiche convertono l'energia elettrica in energia chimica. |
| Reazione | In una cella galvanica avviene una reazione spontanea. | Nelle celle elettrolitiche avvengono reazioni redox non spontanee. |
| oneri | La carica negativa è all'anodo mentre la carica positiva è al catodo. | La carica negativa è al catodo mentre la carica positiva è all'anodo. |
| Ossidazione | Il processo di ossidazione avviene all'anodo. | L'ossidazione avviene al catodo. |
| Collocamento | Le mezze celle sono collocate in diversi contenitori e sono collegate tramite un ponte salino. | In una soluzione elettrolitica, gli elettrodi sono posti nello stesso contenitore. |
| Applicazioni | Utilizzato nelle batterie. | Principalmente utilizzato nella galvanica e anche nella purificazione del rame. |
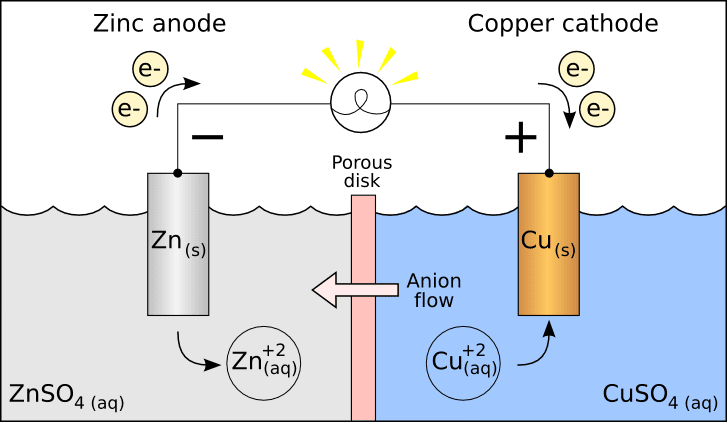
Cosa sono le celle galvaniche?
In una cella galvanica la reazione redox che provoca il trasferimento di elettroni tra le specie è spontanea. E questa quantità di lavoro elettrico è svolta dall'energia di Gibbs per la reazione spontanea.
Le due semicelle di una cella galvanica sono mantenute separate in due contenitori e collegate con un ponte salino. Gli elettrodi metallici presenti in ciascuna semicella sono immersi in un elettrolita soluzione.
Se gli elettrodi sono immersi nello stesso elettrolita, non è necessario il ponte salino.
Ci sono sei parti in una cella galvanica, vale a dire, anodo, catodo, ponte salino, semicelle, un circuito esterno e carico.
In questa cella l'anodo ha un potenziale negativo e il catodo ha un potenziale positivo, entrambi riguardanti la soluzione.
Quindi, quando l'interruttore è acceso, a causa della differenza di potenziale creata, gli elettroni iniziano a fluire dall'anodo al catodo.
Il concetto di celle galvaniche/elettrochimiche è stato introdotto per studiare le proprietà termodinamiche dei sali fusi. Di seguito è riportata la reazione della cella di Daniel, un tipo di cella galvanica.
Al catodo: Cu 2+ + 2e– → Cu (ridotto)
All'anodo: Zn → Zn2+ + 2e– (ossidato)
Le celle galvaniche sono un esempio di come una semplice reazione produca energia e quell'energia possa essere utilizzata per produrre elettricità. Queste celle sono utilizzate principalmente nelle batterie.
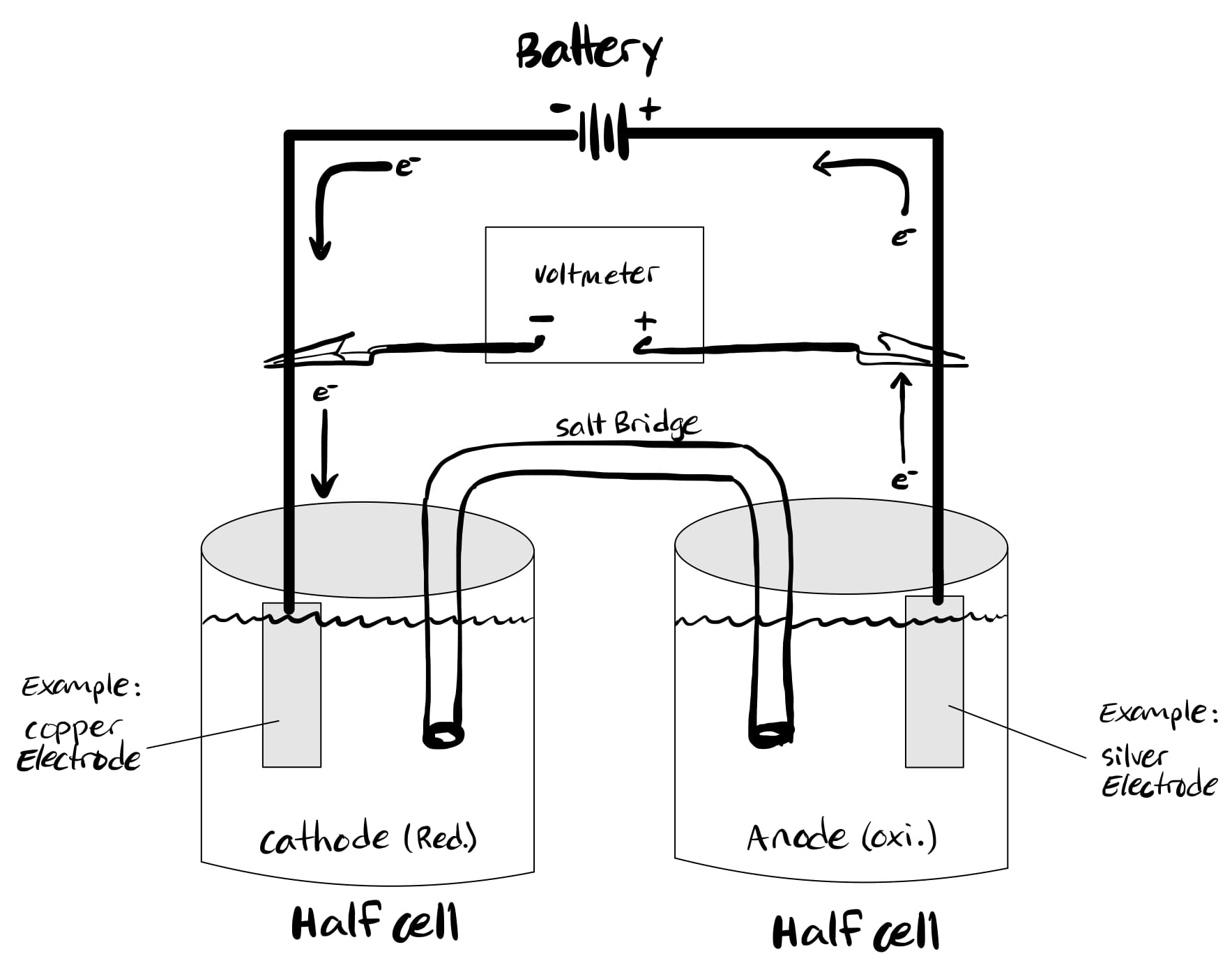
Cosa sono le celle elettrolitiche?
Mentre le celle voltaiche (galvaniche) sono guidate da reazioni chimiche spontanee, le celle elettrolitiche sono guidate da reazioni redox non spontanee.
Converte l'energia elettrica in energia chimica, esattamente l'opposto delle celle galvaniche. In una cella elettrolitica, ossidazione avviene al catodo mentre la riduzione avviene all'anodo.
Questo a volte crea confusione perché l'ossidazione avviene nell'anodo. Quindi, è più facile ricordare che, in una cella elettrolitica, l'anodo è positivo mentre il catodo è negativo.
L'energia di Gibbs complessiva è positiva in quanto le reazioni non sono spontanee. Le celle elettrolitiche possono essere utilizzate per l'elettrolisi di alcuni composti, come l'acqua.
Se l'acqua viene elettrolizzata utilizzando una cella elettrolitica, avrà luogo la formazione di ossigeno gassoso e idrogeno.
Il meccanismo di una cella elettrolitica può essere ben compreso utilizzando l'esempio del cloruro di sodio fuso (NaCl). Di seguito sono riportate le reazioni cellulari.
Al catodo: [Na+ + e– → Na] x 2 (ridotto)
All'anodo: 2Cl– → Cl2 + 2e– (ossidato)
Reazione cellulare: 2NaCl → 2Na + Cl2
Per eseguire le suddette reazioni, due elettrodi vengono immersi nel NaCl fuso e quando l'elettricità passa attraverso il circuito, il catodo si carica negativamente.
Quindi, gli ioni di sodio (caricati positivamente) sono attratti verso il catodo e quindi formano sodio metallico durante la riduzione.
Principali differenze tra celle galvaniche e celle elettrolitiche
- Le celle galvaniche sono celle elettrochimiche che possono produrre elettricità mentre le celle elettrolitiche sono anche celle elettrochimiche ma usano l'energia elettrica per facilitare le reazioni chimiche.
- Le celle galvaniche convertono l'energia chimica in energia elettrica mentre le celle elettrolitiche convertono l'energia elettrica in energia chimica.
- In una cella galvanica avviene una reazione spontanea mentre, nelle celle elettrolitiche, avvengono reazioni redox non spontanee.
- In una cella galvanica, la carica negativa è all'anodo mentre la carica positiva è al catodo mentre, in una cella elettrolitica, è il contrario.
- Il processo di ossidazione avviene all'anodo in una cella galvanica ma nel caso di una cella elettrolitica avviene nel catodo.
- Le semicelle sono poste in contenitori diversi in una cella galvanica mentre nelle celle elettrolitiche gli elettrodi sono presenti nello stesso contenitore.
- https://avesis.marmara.edu.tr/yayin/17177586-0673-4859-9b7c-66eafdae92d7/prospective-teachers-conceptual-understanding-of-electrochemistry-galvanic-and-electrolytic-cells
- https://onlinelibrary.wiley.com/doi/abs/10.1002/(SICI)1098-2736(199704)34:4%3C377::AID-TEA7%3E3.0.CO;2-O
Ultimo aggiornamento: 30 giugno 2023

Piyush Yadav ha trascorso gli ultimi 25 anni lavorando come fisico nella comunità locale. È un fisico appassionato di rendere la scienza più accessibile ai nostri lettori. Ha conseguito una laurea in scienze naturali e un diploma post-laurea in scienze ambientali. Puoi leggere di più su di lui sul suo pagina bio.


Ottimo articolo che spiega molto chiaramente le differenze tra celle galvaniche ed elettrolitiche e le loro diverse applicazioni. La reazione della cella di Daniel e l'esempio del cloruro di sodio fuso sono stati molto utili. Spiegazione molto approfondita ed esauriente.
Questo articolo fornisce un buon confronto tra celle galvaniche ed elettrolitiche. Sembra però che l'autore si sia preso troppe libertà in termini tecnici. Questo avrebbe potuto essere più semplice da capire.
Disaccordo. Se stai cercando di apprendere un argomento complesso come questo, dovresti essere preparato ad affrontare termini e concetti tecnici.
Mi sento allo stesso modo. Ci sono molte informazioni da consumare in una volta.
È molto interessante leggere come funzionano queste cellule e le loro diverse applicazioni. Ottimi esempi, facili da capire per chi ha un background scientifico.
Gli esempi sono stati sicuramente la parte migliore. Hanno reso le informazioni molto più facili da comprendere.
Questo è molto informativo, ma la spiegazione è un po' troppo tecnica e potrebbe essere difficile da comprendere per il grande pubblico.
La terminologia utilizzata è molto avanzata e potrebbe richiedere alcune conoscenze prerequisite in campo scientifico o ingegneristico per comprenderla in profondità.
Lo scrittore ha fatto un buon lavoro spiegando i due tipi di cellule. Inoltre, sono contento che questo testo non si trovi nei libri di testo.
Questo sarebbe più che difficile da comprendere per uno studente delle scuole superiori. Questo dovrebbe essere pubblicato per studenti di ingegneria o scienziati.
Su questo sono d'accordo con Lauren. Questo è più un materiale per un corso di scienze di livello avanzato.
Questo è un articolo molto informativo, ho letto diversi articoli ma l'ho trovato molto completo, copre tutte le nozioni di base essenziali e altro ancora. Esattamente quello che stavo cercando.