Voedingsstoffen in voeding kunnen niet direct door het lichaam worden opgenomen. Ze moeten door verschillende enzymen in kleinere delen worden afgebroken.
In het geval van eiwitten helpen specifieke enzymen om ze af te breken tot aminozuren die het lichaam gebruikt. Deze enzymen zijn van twee soorten, namelijk chymotrypsine en trypsine.
Key Takeaways
- Chymotrypsine is een proteolytisch enzym dat peptidebindingen op aromatische aminozuren splitst.
- Trypsine is een ander proteolytisch enzym dat zich richt op peptidebindingen op basische aminozuren.
- Beide enzymen spelen een essentiële rol bij de eiwitvertering in het spijsverteringsstelsel.
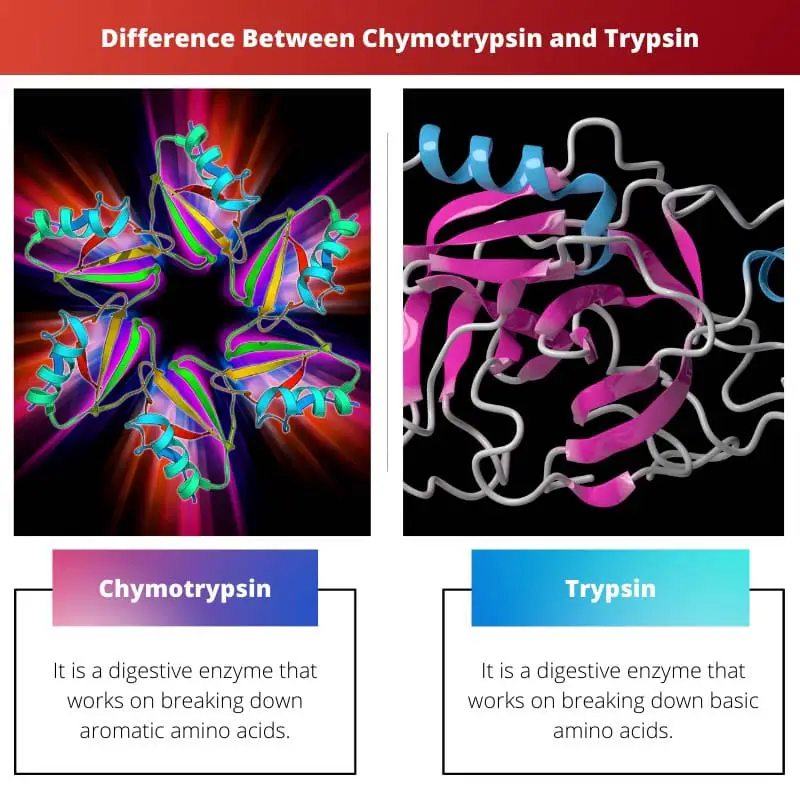
Chymotrypsine versus trypsine
Chymotrypsine is een spijsverteringsenzym dat eiwitten afbreekt tot kleinere peptiden en aminozuren. Trypsine splitst peptide bindingen aan de carboxylzijde van essentiële aminozuren. Trypsine wordt geproduceerd in de alvleesklier en is belangrijk voor de vertering van eiwitten in de dunne darm.

Chymotrypsine is een enzym dat in wezen het verteringsproces ondersteunt door eiwitten af te breken. Het wordt uitgescheiden door de alvleesklier als bestanddeel van pancreassap.
Het enzym wordt geactiveerd door zijn voorloper, die chymotrypsinogeen wordt genoemd. Dit is een inactief enzym dat alleen functioneert in aanwezigheid van Trypsine.
Ondertussen is trypsine een ander soort spijsverteringsenzym dat met verschillende aminozuren werkt. Het wordt ook geproduceerd door de alvleesklier.
Het meeste werk wordt echter uitgevoerd in de dunne darm. De voorloper is een inactief enzym dat trypsinogeen wordt genoemd. Het inactieve enzym functioneert alleen in aanwezigheid van enterokinase.
Vergelijkingstabel
| Parameters van vergelijking: | Chymotrypsine | trypsine |
|---|---|---|
| De reis van mijn leven | Het werd ontdekt in de jaren 1900. | Het werd ontdekt in 1876. |
| Betekenis | Het is een spijsverteringsenzym dat werkt aan het afbreken van aromatische aminozuren. | Het is een spijsverteringsenzym dat werkt aan het afbreken van basische aminozuren. |
| Voorloper | De voorloper is een inactief enzym dat chymotrypsinogeen wordt genoemd. | De voorloper is een inactief enzym dat trypsinogeen wordt genoemd. |
| Activering | De voorloper wordt geactiveerd met behulp van Trypsine. | De voorloper wordt geactiveerd met behulp van enterokinase. |
| Aminozuren | Het selecteert aminozuren, waaronder tyrosine, tryptofaan en fenylalanine. | Het selecteert aminozuren, waaronder arginine en lysine. |
| u gebruikt | Het kan worden gebruikt voor het in kaart brengen van peptiden, peptidesynthese, analyse en zelfs vingerafdrukken. | Het kan worden gebruikt voor weefseldissociatie, mitochondriale isolatie en celoogst. |
| remmers | Zijn remmers omvatten benzamidine, aprotinine, DFP, EDTA, Ag+, enz. | De remmers omvatten boorzuren, peptidylaldehyden, coumarinederivaten, enz. |
Wat is chymotrypsine?
Chymotrypsine is een spijsverteringsenzym dat voor het eerst werd ontdekt in de jaren 1900. Het maakt deel uit van de serineproteasefamilie en valt onder de categorie endopeptidasen.
Het enzym heeft een moleculaire massa van 25.6 kDa. De voorloper ervan wordt chymotrypsinogeen genoemd. Dit is een inactief enzym dat wordt geactiveerd met behulp van trypsine.
Wanneer dit gebeurt, wordt chymotrypsine gevormd en vrijgegeven uit de pancreas als bestanddeel van pancreassap.
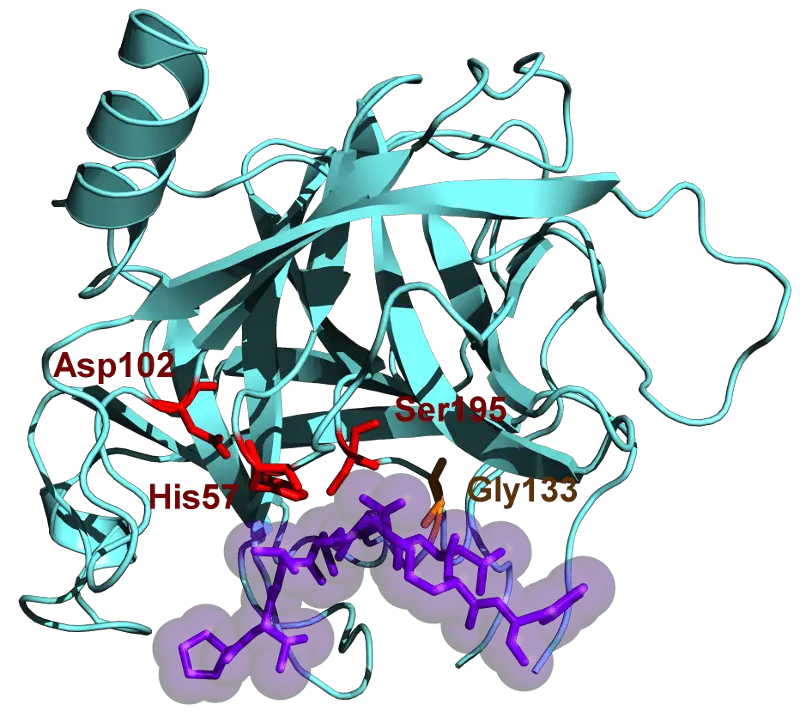
Elk enzym heeft een actieve plaats erin die is gebouwd voor bepaalde structuren en afmetingen om erin te passen. Dit betekent dat het enzym specifieke aminozuren moet selecteren die erin passen.
In het geval van chymotrypsine worden alleen aromatische aminozuren geselecteerd.
Deze omvatten tyrosine, tryptofaan en fenylalanine. Zodra ze de actieve site van het enzym binnenkomen, worden hun peptidebindingen verbroken zodat ze kunnen worden verteerd.
Deze enzymen dienen verschillende doeleinden in medische en Vito-studies. Ze worden gebruikt voor het in kaart brengen van peptiden, peptidesynthese, analyse en zelfs vingerafdrukken.
Er zijn ook bepaalde remmers die binden met chymotrypsine om de activiteit ervan te verminderen. Deze omvatten benzamidine, aprotinine, DFP, EDTA, Ag+, enz.
Ze worden aangetroffen in supplementen die worden voorgeschreven aan mensen met disfunctionele chymotrypsine-enzymen.
Wat is trypsine?
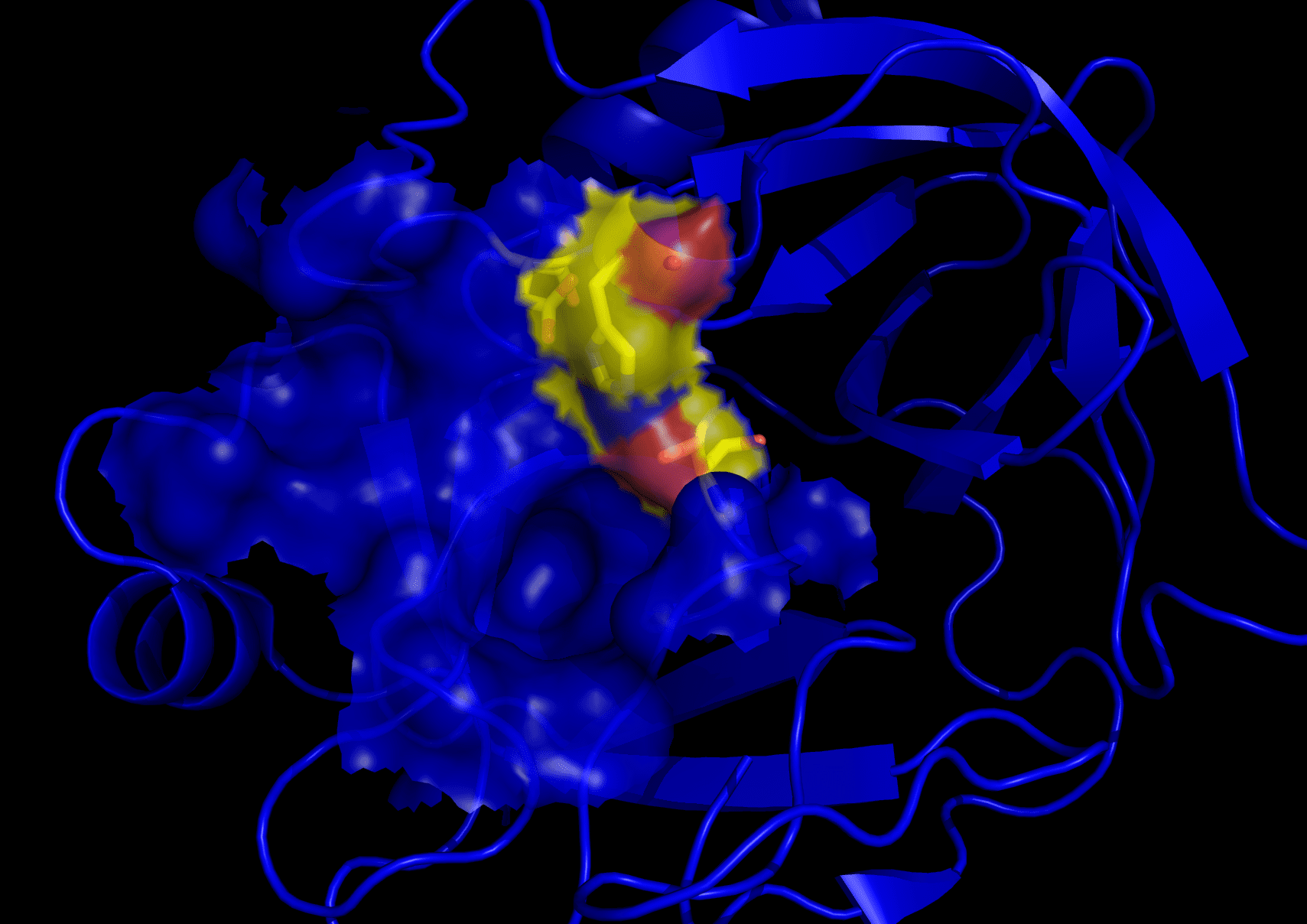
Trypsine is een ander spijsverteringsenzym, maar het werd veel eerder ontdekt, in het jaar 1876. Het behoort ook tot de familie van serineproteasen, maar valt onder de categorie van bolvormige eiwitten.
De molecuulmassa van trypsine is 23.3 kDa. Zijn functie is om peptidebindingen in aminozuren te verbreken.
Het enzym komt vrij uit de alvleesklier uit zijn voorloper genaamd trypsinogeen.
Dit inactieve enzym komt in contact met enterokinase voor activatie. Zodra dit gebeurt, wordt het naar de dunne darm vervoerd, waar het grootste deel van zijn functioneren plaatsvindt.
Het enzym selecteert alleen bepaalde basische aminozuren in zijn actieve plaats. Deze omvatten arginine en lysine.
Trypsine heeft verschillende toepassingen bij weefseldissociatie, mitochondriale isolatie en celoogst. Het heeft ook verschillende remmers, waaronder boorzuren, peptidylaldehyden, coumarinederivaten, enz.
Deze zijn te vinden in verschillende supplementen die tal van medische toepassingen hebben.
Trypsine is van twee hoofdtypen. Deze omvatten alfa-trypsine en bèta-trypsine. Elk van hen heeft een andere structuur en functioneert bij een andere thermische stabiliteitsdrempel.
Beide actieve sites bevatten echter asparaginezuur, histidine en serine, die helpen bij het hele proces van het afbreken van aminozuren. Ze doen dit door het c-terminale uiteinde, dat koolstof bevat, te klieven.
Belangrijkste verschillen tussen chymotrypsine en trypsine
- Chymotrypsine werd ontdekt in de jaren 1900, terwijl trypsine werd ontdekt in 1876.
- Chymotrypsine is een spijsverteringsenzym dat aromatische aminozuren afbreekt, terwijl trypsine een spijsverteringsenzym is dat basische aminozuren afbreekt.
- Chymotrypsine selecteert aminozuren, waaronder tyrosine, tryptofaan en fenylalanine, terwijl trypsine aminozuren selecteert, waaronder arginine en lysine.
- De voorloper van chymotrypsine is een inactief enzym dat chymotrypsinogeen wordt genoemd, terwijl dat van trypsine een inactief enzym is dat trypsinogeen wordt genoemd.
- De voorloper van chymotrypsine wordt geactiveerd met behulp van trypsine, terwijl die van trypsine wordt geactiveerd met behulp van enterokinase.
- Chymotrypsine kan worden gebruikt voor het in kaart brengen van peptiden, peptidesynthese, analyse en zelfs vingerafdrukken, terwijl trypsine kan worden gebruikt voor weefseldissociatie, mitochondriale isolatie en celoogst.
- Chymotrypsineremmers omvatten benzamidine, aprotinine, DFP, EDTA, Ag+, enz., terwijl trypsineremmers boorzuren, peptidylaldehyden, coumarinederivaten, enz. omvatten.
- https://www.sciencedirect.com/science/article/pii/0022283672900289
- https://www.sciencedirect.com/science/article/pii/0014579395014845
Laatst bijgewerkt: 11 juni 2023

Piyush Yadav heeft de afgelopen 25 jaar als natuurkundige in de lokale gemeenschap gewerkt. Hij is een natuurkundige die gepassioneerd is om wetenschap toegankelijker te maken voor onze lezers. Hij heeft een BSc in natuurwetenschappen en een postdoctoraal diploma in milieuwetenschappen. Je kunt meer over hem lezen op zijn bio pagina.


Uitstekende gedetailleerde vergelijking van de twee enzymen. Zeer informatief en goed geschreven.
Ja, het is een zeer informatief artikel. Goed verklaarde verschillen tussen de twee enzymen.
Ik heb hier veel van geleerd. De precieze informatie maakt het gemakkelijk te begrijpen.
Dit artikel geeft een goed inzicht in Chymotrypsine en Trypsine. Echt leerzaam.
Zeer goed onderzocht en informatief. Een must-read voor iedereen die geïnteresseerd is in dit onderwerp.
Ik vond dit artikel zeer verhelderend en duidelijk. Ik had geen idee dat er zo'n verschil was tussen deze twee enzymen.
Ik ben het ermee eens, een zeer grondige vergelijking tussen Chymotrypsine en Trypsine.
Ja, de nauwkeurigheid van het artikel maakt het zeer informatief om te lezen.
De gedetailleerde vergelijking van deze twee spijsverteringsenzymen is fascinerend. Een zeer verhelderende lectuur.
De gedetailleerde afbraak van beide enzymen is heel duidelijk en nuttig!
Mee eens, het artikel is goed gestructureerd en gemakkelijk te volgen.
Ja, een geweldige bron van informatie over dit onderwerp.
Een goed onderbouwd stuk schrijven. Bedankt voor het delen!
Bedankt voor dit uitgebreide overzicht van de verschillen tussen Chymotrypsine en Trypsine.