Các thuật ngữ như Nguyên tố và Nguyên tử thường được sử dụng khi học Hóa học và đôi khi là Vật lý. Tuy nhiên, khi chủ đề tiến bộ và ngày càng phức tạp hơn, ý nghĩa của các thuật ngữ có thể dễ bị nhầm lẫn.
Chìa khóa chính
- Các nguyên tố không thể bị phân hủy thành các chất đơn giản hơn bằng phương pháp hóa học. Đồng thời, Nguyên tử là hạt nhỏ nhất của nguyên tố còn giữ nguyên tính chất hóa học của nguyên tố đó.
- Các nguyên tố có số nguyên tử duy nhất xác định tính chất và vị trí của chúng trên bảng tuần hoàn, trong khi Nguyên tử có proton, electron và neutron xác định hành vi và tương tác của chúng.
- Các nguyên tố có thể kết hợp với nhau để tạo thành các hợp chất, nhưng các nguyên tử của cùng một nguyên tố không thể bị phá vỡ thêm mà không làm thay đổi tính chất hóa học của chất.
Các yếu tố so với nguyên tử
Các nguyên tố và nguyên tử khác nhau vì một thành phần là dạng đơn giản nhất của một chất được tạo thành từ các nguyên tử. Một khía cạnh được phân loại tùy thuộc vào số nguyên tử của nó. Các hạt hạ nguyên tử kết hợp với nhau để tạo thành các nguyên tử, chúng hợp nhất để tạo ra một nguyên tố. Sau đó, các yếu tố kết hợp để tạo thành các phân tử.

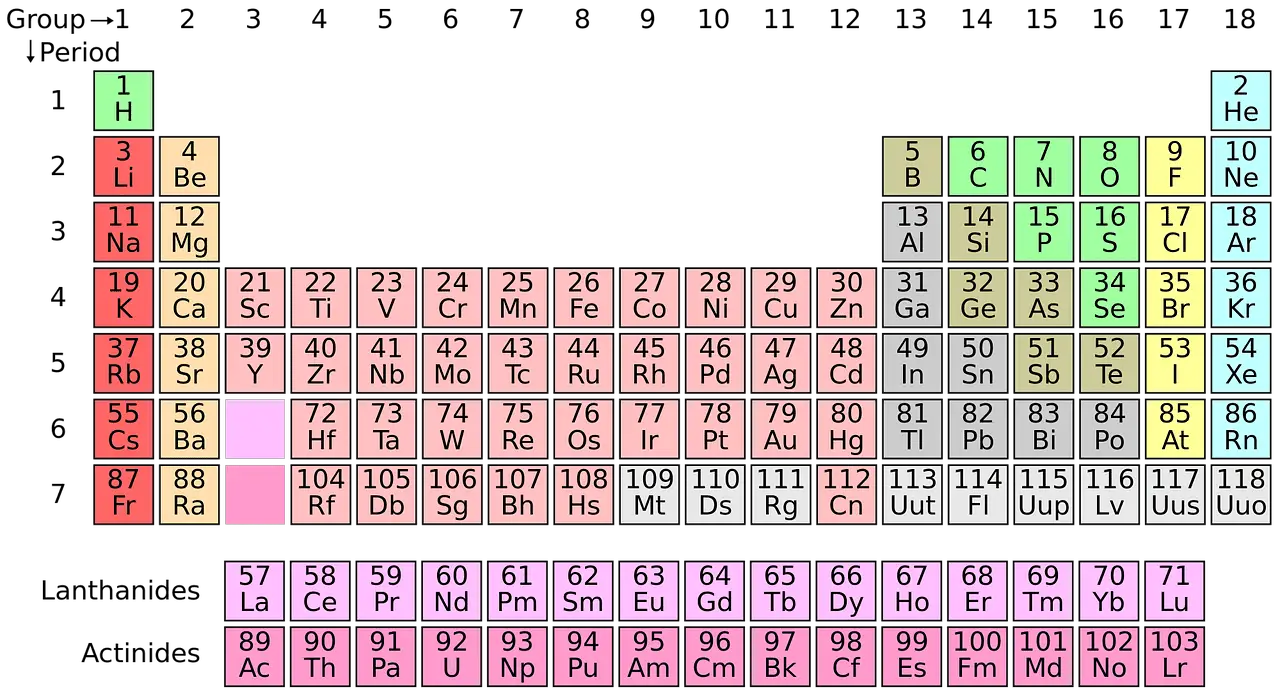
Không giống như các hợp chất hóa học, các nguyên tố hóa học không thể được phân chia thành các chất đơn giản hơn bằng bất kỳ phương pháp hóa học nào. Trong bảng tuần hoàn các nguyên tố, các nguyên tố được hệ thống hóa theo số hiệu nguyên tử.
Một nguyên tử là phần nhỏ nhất của vật chất thông thường tạo ra một nguyên tố hóa học. Một nguyên tử bao gồm các hạt hạ nguyên tử. Nói một cách đơn giản, các nguyên tử là những viên gạch xây dựng để cấu thành nên các nguyên tố.
Bảng so sánh
| Các thông số so sánh | Các yếu tố | Nguyên tử |
|---|---|---|
| Kích thước máy | Lớn hơn nguyên tử | Rất nhỏ (thậm chí không thể nhìn thấy dưới kính hiển vi) |
| Số loại | Tổng cộng có 118 phần tử. | Có khoảng 92 loại nguyên tử có sẵn trong tự nhiên. |
| Sáng tác | Một phần tử cụ thể chỉ bao gồm một loại nguyên tử cụ thể. | Các nguyên tử bao gồm các hạt hạ nguyên tử. Chúng là proton, electron và neutron. |
| Khi họ kết hợp | Các nguyên tố kết hợp với nhau để tạo thành các phản ứng hóa học mới. | Khi các nguyên tử kết hợp với nhau, chúng tạo thành một phân tử. |
| Trọng lượng máy | Nặng hơn một nguyên tử cụ thể. | Cực nhẹ (Trọng lượng tương đối là 1 AMU) |
Các yếu tố là gì?
Một nguyên tố là một khái niệm cơ bản mà người ta phải biết để hiểu hóa học nâng cao. Trong hạt nhân nguyên tử của nó, một nguyên tố chỉ gồm những nguyên tử chứa cùng số proton.
Các nguyên tố hóa học không thể được chia thành các nguyên tố hoặc chất đơn giản hơn bằng bất kỳ phương pháp hóa học nào. Cái sau được quy cho số nguyên tử, được biểu thị bằng biểu tượng 'Z.'
Hóa học hiện đại phụ thuộc rất nhiều vào bảng tuần hoàn. Tất cả các yếu tố được phát hiện được phân loại và sắp xếp có hệ thống trong bảng tuần hoàn. Khái niệm này được nghĩ ra bởi Tiếng Nga nhà hóa học Dmitri Mendeleev vào năm 1869.
Các đặc tính của một nguyên tố chịu trách nhiệm về trạng thái vật lý của nó ở nhiệt độ phòng hoặc nhiệt độ trung bình. Nó có thể ở trạng thái khí hoặc rắn hoặc lỏng.
Tổng cộng có khoảng 118 loại nguyên tố.
Một vài ví dụ về các phần tử như sau:
- Hydro
- Carbon
- neon
- Magnesium
- Aluminium
- Boron
Nguyên tử là gì?
Nguyên tử là đơn vị nhỏ nhất của vật chất thông thường. Chúng rất nhỏ, với kích thước xấp xỉ 100 picômét. Ngoài ra, một nguyên tử có trọng lượng cực kỳ nhẹ. Tương đối trọng lượng của cái sau tương đối là 1AMU.
Hạt nhân bao gồm một hoặc nhiều proton và một số neutron. Chỉ có một ngoại lệ cho quy tắc này: Hydrogen, không có neutron. Lõi chiếm 99.94% khối lượng nguyên tử.
Các proton sở hữu một điện tích dương, các electron chứa một lượng điện âm, và các neutron không có điều khiển điện. Một nguyên tử trung hòa về điện khi số proton và electron bằng nhau.
Có 92 loại nguyên tử khác nhau trong tự nhiên.
Khái niệm cơ bản và khái niệm rằng vật chất bao gồm các hạt nhỏ không thể phân chia được là cổ xưa. Lịch sử của các nguyên tử quay trở lại thời cổ đại của Ấn Độ và Hy Lạp.

Sự khác biệt chính giữa các yếu tố và nguyên tử
- Khi nhiều nguyên tố kết hợp với nhau, chúng tạo thành một phản ứng hóa học mới dẫn đến một nguyên tố mới. Khi nhiều hơn một nguyên tử kết hợp với nhau (giữ cho các chất khác nhau không đổi), chúng tạo thành một phân tử.
- Trọng lượng của nguyên tố nặng hơn khi so sánh với nguyên tử, trong khi đó, trong trường hợp nguyên tử, nguyên tử lại cực kỳ nhẹ. Trọng lượng tương đối của cái sau là khoảng 1 AMU.
- https://books.google.com/books?hl=en&lr=&id=EvTI-ouH3SsC&oi=fnd&pg=PP1&dq=elements&ots=pQ5TOAfsJ3&sig=LBL5oWU1-cH9p_y8JPtdmdjok7g
- https://pubs.acs.org/doi/pdf/10.1021/ar00109a003
Cập nhật lần cuối: ngày 11 tháng 2023 năm XNUMX

Piyush Yadav đã dành 25 năm qua làm việc với tư cách là một nhà vật lý trong cộng đồng địa phương. Anh ấy là một nhà vật lý đam mê làm cho khoa học dễ tiếp cận hơn với độc giả của chúng tôi. Ông có bằng Cử nhân Khoa học Tự nhiên và Bằng Sau Đại học về Khoa học Môi trường. Bạn có thể đọc thêm về anh ấy trên trang sinh học.

Những lời giải thích sâu sắc giúp bạn dễ dàng nắm bắt được sự khác biệt giữa các nguyên tố và nguyên tử, đồng thời tăng thêm giá trị giáo dục to lớn.
Việc so sánh chi tiết các nguyên tố và nguyên tử đã được chứng minh là một tài sản giáo dục.
Việc so sánh rõ ràng và chi tiết giữa các nguyên tố và nguyên tử đã giúp bạn dễ dàng hiểu được sự khác biệt của chúng, đóng vai trò như một công cụ học tập tuyệt vời.
Tìm hiểu về sự khác biệt giữa các nguyên tố và nguyên tử từ bài viết này khá sâu sắc và mang tính giáo dục.
Nội dung thông tin về các nguyên tố, nguyên tử đã làm cho việc so sánh giữa hai khái niệm khá rõ ràng và dễ hiểu.
Bài viết này đã cung cấp sự so sánh chi tiết và toàn diện giữa các nguyên tố và nguyên tử, đồng thời đưa ra cái nhìn sâu sắc vô giá về các đặc điểm và hành vi tương ứng của chúng.
Tôi rất ấn tượng với sự so sánh rõ ràng về sự khác biệt giữa các nguyên tố và nguyên tử được cung cấp trong bài viết này.
Bài viết có giá trị giáo dục rất lớn, đặc biệt đối với những ai có niềm đam mê khoa học, hóa học.
Đây chắc chắn là một nguồn tài nguyên quý giá cho những ai muốn tìm hiểu về các nguyên tố và nguyên tử.
Nó đã được chứng minh là có giá trị trong việc tìm hiểu khái niệm khoa học cơ bản về các nguyên tố và nguyên tử.
Việc so sánh toàn diện các nguyên tố và nguyên tử đã giúp chúng ta hiểu rõ hơn về các khái niệm khoa học này.
Việc đi sâu vào việc so sánh các nguyên tố và nguyên tử đã mang lại trải nghiệm giáo dục quý giá, giúp bạn hiểu các khái niệm khoa học này dễ dàng hơn.
Bài viết này đã thành công trong việc đưa ra sự so sánh sâu sắc và toàn diện giữa các nguyên tố và nguyên tử, rất có lợi cho mục đích giáo dục và hiểu biết các khái niệm khoa học.
Giá trị giáo dục của sự so sánh giữa các nguyên tố và nguyên tử trong bài viết này thực sự đáng khen ngợi.
Các chi tiết toàn diện về những điểm chính của các nguyên tố so với nguyên tử rất hữu ích để hiểu rõ hơn về các khái niệm này.