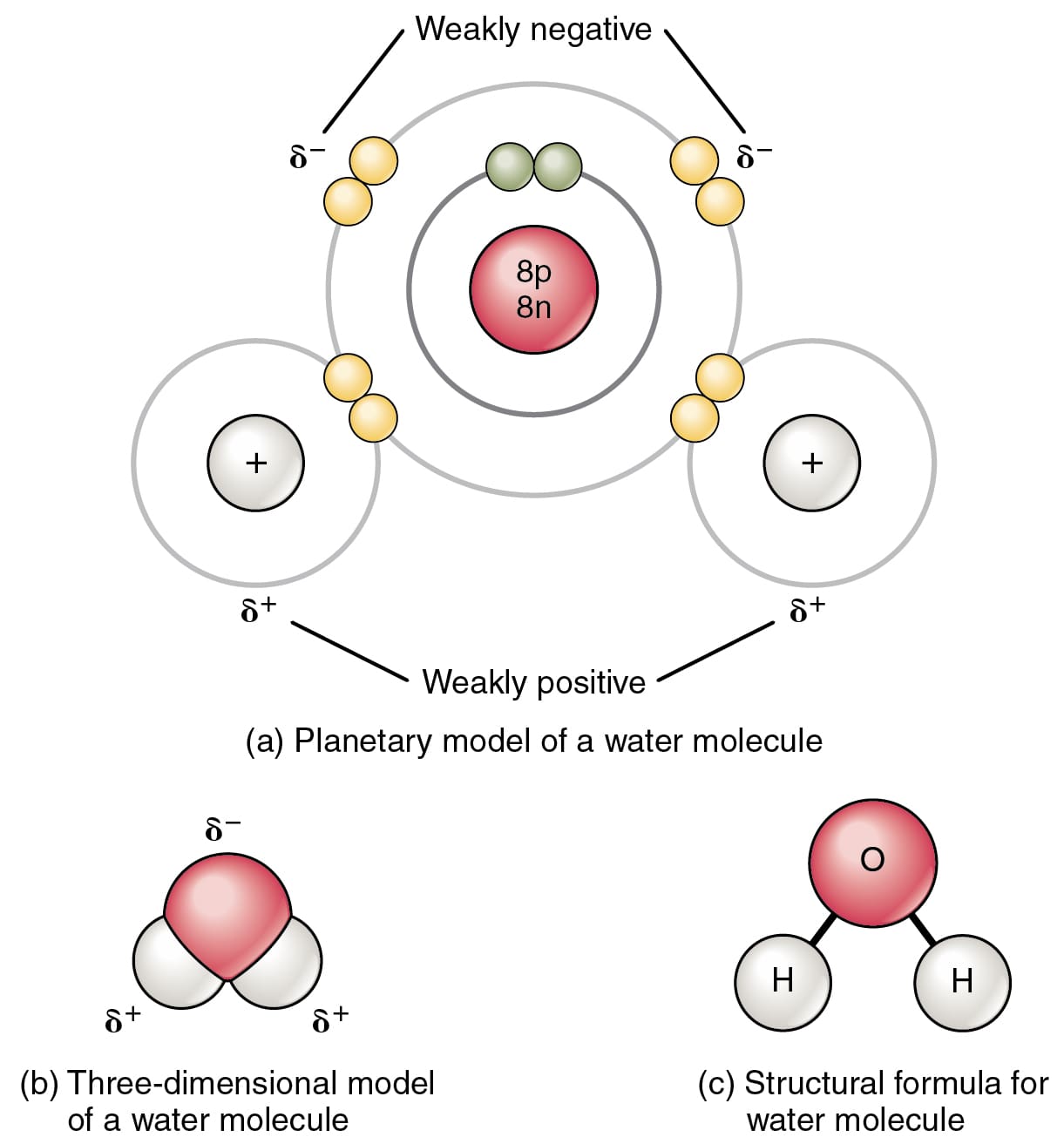
هناك الكثير من الأشياء في الطبيعة التي ترتبط ببعضها البعض لتشكيل بنية جديدة أو فئة جديدة من العناصر. على سبيل المثال: فكر في الماء ، كيف تتشكل؟
يتكون من خلال عملية الترابط الكيميائي حيث تترابط ذرتان من الهيدروجين وذرة واحدة من الأوكسجين لتكوين الحالة السائلة للماء. يعتبر الترابط الكيميائي مهمًا للكائنات الحية وللعمل السليم لأجزاء الجسم.
الوجبات السريعة الرئيسية
- تتشكل الروابط الأيونية بين العناصر المعدنية وغير المعدنية من خلال نقل الإلكترون ، بينما تتشكل الروابط التساهمية بين اللافلزات من خلال مشاركة الإلكترون.
- تحدث الروابط المعدنية بين ذرات المعادن ، بما في ذلك بحر من الإلكترونات غير المحددة.
- المركبات الأيونية لها نقاط انصهار وغليان عالية. المركبات التساهمية لها نقاط انصهار وغليان أقل ، والمركبات المعدنية لها نقاط انصهار وغليان متفاوتة.
السندات الأيونية مقابل التساهمية مقابل السندات المعدنية
تتشكل الروابط الأيونية بين الأيونات ذات الشحنات المعاكسة. يمكن أن تتشكل هذه الأيونات عن طريق نقل إلكترون أو أكثر من ذرة إلى أخرى. تتشكل الروابط التساهمية عندما تتشارك الذرات في زوج واحد أو أكثر من الإلكترونات. يحدث هذا النوع من الروابط بين ذرتين غير معدنيتين. تتشكل الروابط المعدنية بين ذرات المعادن. في الرابطة المعدنية، لا تتمركز إلكترونات التكافؤ في ذرة معينة، بل تكون حرة في الحركة عبر الشبكة المعدنية بأكملها.

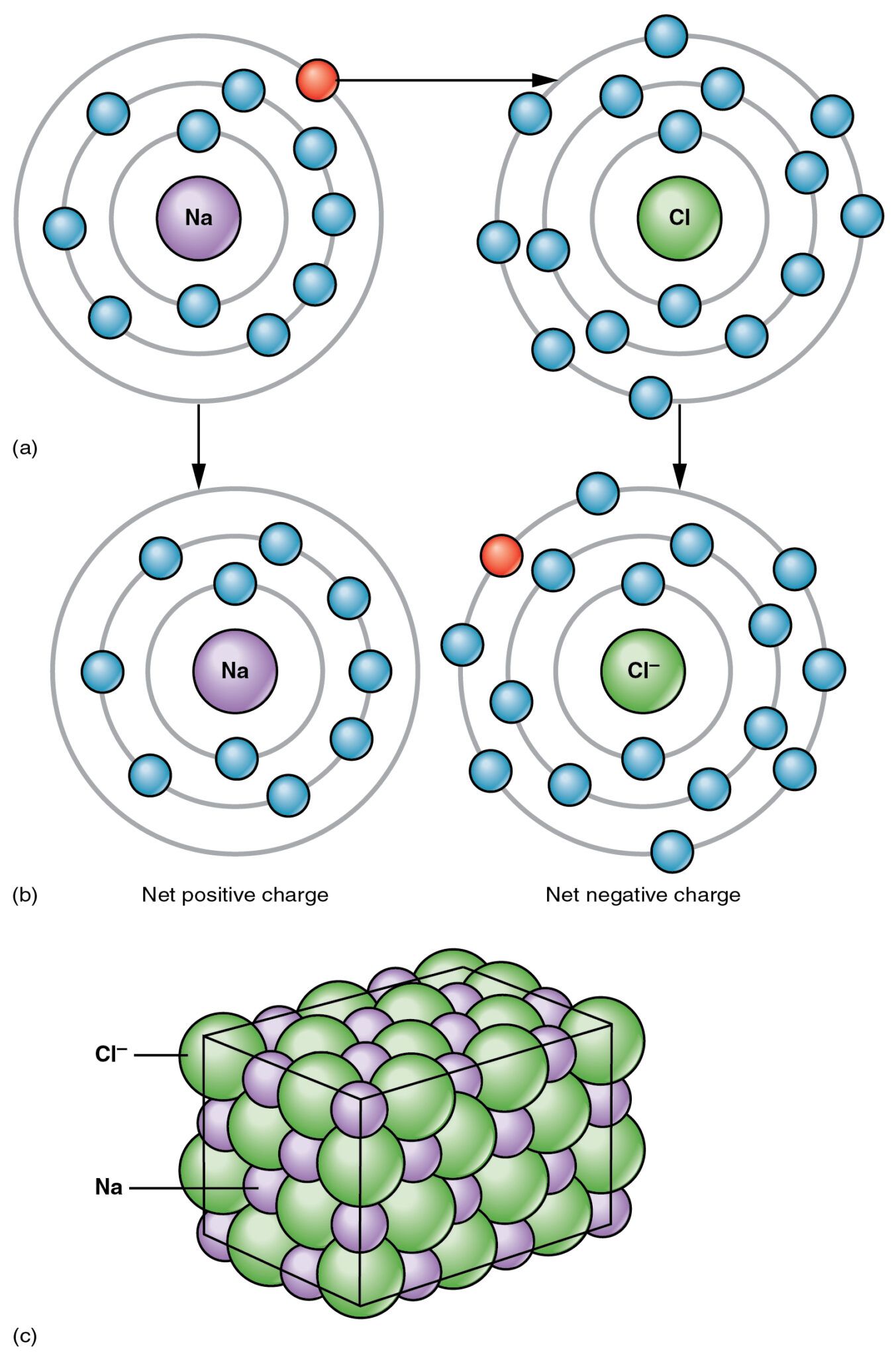
الرابطة الأيونية هي نقل الإلكترونات من ذرة معدنية إلى ذرة غير فلزية ، على سبيل المثال ، ضع في اعتبارك كلوريد الصوديوم ؛ العدد الذري للصوديوم هو 11 والتكوين الإلكتروني هو 2,8,1،XNUMX،XNUMX يحتوي الصوديوم على إلكترون إضافي في غلافه الخارجي.
من ناحية أخرى، الكلورالعدد الذري لـ 17 والتكوين الإلكتروني هو 2,8,7،7،XNUMX يحتوي الكلور على XNUMX إلكترونات في غلافه الخارجي ، لذا يحتاج الكلور إلى إلكترون آخر لإكمال غلافه الخارجي حتى تكون جميع الذرات مستقرة.
نظرًا لأن الصوديوم يحتوي على إلكترون إضافي عندما يتفاعل الصوديوم مع Chorine ، فإن الصوديوم يتبرع بهذا الإلكترون الإضافي إلى Chorine. في هذه العملية ، يصبح الصوديوم أيونات موجبة الشحنة (Na +) وبعد قبول الإلكترون الكورين يصبح أيونات سالبة الشحنة (Cl-).
يتم الاحتفاظ بهذين الأيونات المشحونة بشكل معاكس بواسطة قوة جذب إلكتروستاتيكية قوية تُعرف باسم الرابطة الأيونية.
A الرابطة التساهمية تتشكل عندما تتحد ذرتان أو أكثر معًا من خلال المشاركة المتبادلة للإلكترونات. على سبيل المثال ، بالنظر إلى تكوين غاز الأكسجين (O2) ، سنأخذ ذرتين من الأكسجين لأننا نعلم أن عدد الإلكترون في الأكسجين هو 2 وهناك 8 إلكترونات تكافؤ في الغلاف الخارجي.
عندما تحصل قشرتا التكافؤ الخارجيان اللذان يحتويان على 6 إلكترونات من الأكسجين على إلكترونين إضافيين ، فسيكون ذلك مستقرًا ، حيث سيتم الوفاء بقاعدة الثمانية الخاصة به.
لتحقيق الاستقرار ، تتحد هاتان الذرتان من الأكسجين وتتشاركان ذرتين من الأكسجين بشكل متبادل لتكوين غاز الأكسجين ، وهذا ما يسمى بوند التساهمية.
الترابط المعدني هو التجاذب الكهروستاتيكي بين أيونات المعادن المرتبة في هيكل شبكي (نمط متكرر منتظم) والطفو الحر للإلكترونات من حولها.
في الهيكل المعدني ، لا يوجد سوى أيونات معدنية يتم ترتيب هذه الأيونات المعدنية جنبًا إلى جنب في نمط متكرر منتظم ، وتعمل الإلكترونات الحرة العائمة كغراء وتحافظ على الهيكل في مكانه.
هذا عامل جذب قوي للغاية وبالتالي فإن درجة انصهار المعادن ونقطة غليانها عالية جدًا. الإلكترونات العائمة هي الأسباب التي تجعل المعدن موصلًا جيدًا للكهرباء.
جدول المقارنة
| معلمات المقارنة | السندات الأيونية | الرابطة التساهمية | السندات معدنية |
|---|---|---|---|
| تكوين | المعادن وغير المعدنية | اثنان غير معدني | يشحن الذرات والإلكترونات الحرة بشكل إيجابي |
| قطبية | مرتفع | منخفض | الغير قطبي |
| شكل الجزيء | لا يوجد شكل محدد ، هيكل شبكي | شكل محدد | لا يوجد شكل محدد |
| أمثلة | كلوريد الصوديوم ، حامض الكبريتيك | الميثان ، حمض الهيدروكورك | الصوديوم والمغنيسيوم |
| نقطة الانصهار | نقطة انصهار عالية | درجة انصهار منخفضة | نقطة انصهار عالية |
ما هي الرابطة الأيونية؟
يحدث الترابط الأيوني عندما يكون هناك اكتساب وفقدان للإلكترونات بين معدن وغير فلز ، ولكي يحدث الترابط الأيوني ، يجب أن يكون هناك معدن واحد على الأقل.
على سبيل المثال ، فقدت ذرة المغنيسيوم إلكترونين وشكلت أيونات المغنيسيوم المشحونة إيجابياً وهي أيونات معدنية ؛ من ناحية أخرى ، تكتسب ذرة الأكسجين إلكترونين وتصبح أيونات أكسيد سالبة الشحنة وهي غير معدنية.
تجذب هاتان الذرتان بعضهما البعض لأن إحداهما إيجابية والأخرى سلبية وهذا الانجذاب يسمى الارتباط الأيوني.
ما هي الرابطة التساهمية؟
يحدث الترابط التساهمي فقط في المواد غير المعدنية ولا يمكن أبدًا أن يحدث مع المعادن ، ويحدث عندما يتشارك اثنان أو أكثر من معادن غير معدنية في زوج من الإلكترونات بشكل متبادل.
على سبيل المثال ، لدينا ذرتان من الكلور والأغلفة الخارجية لذرات الكلور تتداخل وتتشارك في زوج من الإلكترون لتشكيل عنصر.
يتم ضم الذرتين معًا مما يشكل رابطة قوية جدًا تربطهما معًا. يسمى هذا النوع من الروابط الرابطة التساهمية.
ما هي الرابطة المعدنية؟
يحدث الترابط المعدني بين المعادن ، وتفقد المعادن الإلكترونات لتكوين أيونات موجبة وتصبح الإلكترونات السائبة إلكترونات غير متمركزة مما يعني أنها لم تعد متصلة بأي أيونات وتطفو في بحر من الإلكترونات غير المحددة.
نظرًا لأن الأيونات موجبة والإلكترونات غير الموضعية سالبة ، فسيكون هناك تجاذب بينهما. يسمى التجاذب الكهروستاتيكي بين الأيونات الموجبة والإلكترونات السالبة غير الموضعية الترابط المعدني.
الاختلافات الرئيسية بين الروابط الأيونية والتساهمية والمعدنية
- في الرابطة الأيونية ، توفر ذرة واحدة إلكترونات لأخرى ، في الرابطة التساهمية ذرتان من إلكترونات التكافؤ ، بينما في الرابطة المعدنية ، تتكون الشبكة المعدنية من الذرات التي تشترك في عدة إلكترونات.
- في أيوني طاقة السندات من الرابطة أعلى من الرابطة المعدنية ، وينطبق الشيء نفسه مع الرابطة التساهمية ، بينما في الرابطة المعدنية هناك طاقة رابطة أقل من الروابط الأولية الأخرى.
- الرابطة الأيونية هي موصل ضعيف من ناحية أخرى ، الرابطة التساهمية هي موصل ضعيف للغاية ، في حين أن الرابطة المعدنية هي موصل قوي.
- يمكن أن تكون الرابطة الأيونية في الحالة الصلبة ، ويمكن أن تكون الرابطة التساهمية في الحالة الصلبة والسائلة والغازية ، بينما يمكن أن تكون الروابط المعدنية في الحالة الصلبة فقط.
- لا تحتوي الرابطة الأيونية على سمة قابلة للطرق كما هو الحال مع الرابطة التساهمية ، في حين أن الرابطة المعدنية لها صفة مرنة
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.171.701
- https://www.tandfonline.com/doi/abs/10.1080/00150199208019535
آخر تحديث: 02 يوليو 2023

أمضى بيوش ياداف السنوات الخمس والعشرين الماضية في العمل كفيزيائي في المجتمع المحلي. إنه فيزيائي شغوف بجعل العلم في متناول قرائنا. وهو حاصل على بكالوريوس في العلوم الطبيعية ودبلوم دراسات عليا في علوم البيئة. يمكنك قراءة المزيد عنه على موقعه صفحة بيو.


إن تعقيد التفاعلات بين الأنواع المختلفة من الروابط أمر رائع للغاية.
من المؤكد أن هذه المقالة زادت معرفتي بالروابط الأيونية والتساهمية والمعدنية. لقد قام المؤلف بعمل رائع في تقديم المعلومات.
إن شرح كيفية ارتباط الذرات معًا لتكوين أنواع مختلفة من الروابط موضح جيدًا. وظيفة كبيرة على هذه المقالة!
المقالة مكتوبة بوضوح وهناك الكثير من المعلومات القيمة هنا. أنا أقدر جدول المقارنة، فهو يضع الأمور في نصابها الصحيح.
جدول المقارنة مفيد جدًا وموجز حقًا.
من الواضح أن المؤلف لديه فهم قوي للموضوع وقد قام بتوصيل هذه المبادئ بشكل فعال.
هذه مقالة مفيدة للغاية. إنه يشرح بوضوح الاختلافات بين الروابط الأيونية والتساهمية والمعدنية ويعتبر مرجعًا رائعًا لأي شخص يدرس الكيمياء.
متفق! ويقدم نظرة شاملة للموضوع.
أعتقد أن هذه المقالة ستكون مفيدة جدًا للطلاب في مجال الكيمياء.
هذا التفسير شامل وثاقب بشكل لا يصدق. أشعر وكأنني تعلمت شيئًا حقًا.