Υπάρχουν πολλές κρίσιμες διαφορές μεταξύ ενός ομοιοπολικού και ενός υδρογονανθρακικού δεσμού. Η Χημεία, η μελέτη ουσιών – στοιχείων και ενώσεων, ξεκινά με τα βασικά των δεσμών μεταξύ δύο ατόμων και μορίων.
Αυτό το άρθρο θα εξηγήσει τις διαφορές μεταξύ υδρογόνου και ομοιοπολικών δεσμών και πώς σχηματίζονται. Θα εξετάσουμε τους δύο τύπους χημικών δεσμών. Ο τύπος αλληλεπίδρασης κάνει ένα ομοιοπολικό μόριο διαφορετικό από ένα μόριο υδρογονάνθρακα.
Βασικές τακτικές
- Οι δεσμοί υδρογόνου σχηματίζονται μεταξύ των μορίων όταν ένα άτομο υδρογόνου συνδέεται με ένα εξαιρετικά ηλεκτραρνητικό άτομο. ομοιοπολικοί δεσμοί μοιράζονται ηλεκτρόνια μεταξύ των ατόμων μέσα σε ένα μόριο.
- Οι δεσμοί υδρογόνου είναι πιο αδύναμοι από τους ομοιοπολικούς δεσμούς, παρέχοντας προσωρινές και αναστρέψιμες αλληλεπιδράσεις.
- Οι δεσμοί υδρογόνου συμβάλλουν στη δομή και τη λειτουργία των βιολογικών μορίων. οι ομοιοπολικοί δεσμοί αποτελούν τη βάση των μοριακών δομών.
Δεσμός υδρογόνου εναντίον ομοιοπολικού δεσμού
Οι δεσμοί υδρογόνου προκύπτουν όταν ένα θετικά φορτισμένο άτομο υδρογόνου αλληλεπιδρά με ένα ηλεκτραρνητικό άτομο, δημιουργώντας έναν σχετικά ασθενέστερο δεσμό από τους ομοιοπολικούς δεσμούς που περιλαμβάνουν κοινή χρήση ηλεκτρονίων. Αυτοί οι δεσμοί είναι απαραίτητοι για τις μοναδικές ιδιότητες του νερού. Οι ομοιοπολικοί δεσμοί αποτελούν το θεμέλιο των περισσότερων μορίων.

Ένας δεσμός υδρογόνου μπορεί να είναι είτε ενδομοριακός είτε διαμοριακός. Η ενέργεια που σχετίζεται με έναν δεσμό υδρογόνου ποικίλλει ανάλογα με τη γεωμετρία και το περιβάλλον των ατόμων.
Είναι πιο αδύναμος δεσμός από την αλληλεπίδραση van der Waals, που εμφανίζεται σε οργανικά και ανόργανα μόρια. Μερικά παραδείγματα δεσμών υδρογόνου είναι το σαλικυλικό οξύ, το H2O (νερό), η μεθυλική αλκοόλη, η ζάχαρη κ.λπ.
Οι ομοιοπολικοί δεσμοί είναι μορφές διαμοριακών δυνάμεων. Σχηματίζονται όταν δύο ή περισσότερα άτομα μοιράζονται τα ηλεκτρόνια τους για να γεμίσουν τα εξωτερικά τους κελύφη ηλεκτρονίων. Οι ομοιοπολικοί δεσμοί είναι πολύ ισχυρότεροι από τους δεσμούς υδρογόνου και έχουν υψηλή σταθερότητα.
Συγκριτικός πίνακας
| Παράμετροι σύγκρισης | Δεσμός υδρογόνου | Ομοιοπολικό δεσμό |
|---|---|---|
| Τι είναι? | Ένας δεσμός υδρογόνου είναι μια δύναμη έλξης μεταξύ ενός ατόμου υδρογόνου και ενός πιο ηλεκτραρνητικού ατόμου. | Οι ομοιοπολικοί δεσμοί είναι χημικοί δεσμοί που σχηματίζονται με κοινή χρήση ηλεκτρονίων. |
| Δυνάμεις | Διαμοριακές και Ενδομοριακές δυνάμεις. | Διαμοριακές δυνάμεις. |
| Δύναμη | Σχηματίζεται μεταξύ δύο ατόμων. | Οι ομοιοπολικοί δεσμοί είναι πολύ ισχυρότεροι σε σύγκριση με τους δεσμούς υδρογόνου. |
| Σχηματίζεται μεταξύ | Ένας δεσμός υδρογόνου σχηματίζεται μεταξύ δύο ατόμων δύο διαφορετικών μορίων. | Σχηματίζεται ανάμεσα σε δύο άτομα. |
| Παραδείγματα | Σαλικυλικό οξύ, Νερό, Γλυκόζη κ.λπ. | Μεθάνιο, μονοξείδιο του άνθρακα κ.λπ. |
Τι είναι ο δεσμός υδρογόνου;
Ο δεσμός υδρογόνου είναι μια ηλεκτρική δύναμη έλξης μεταξύ δύο ατόμων. Δημιουργείται όταν ένα άτομο υδρογόνου συνδέεται ομοιοπολικά με ένα άλλο πιο ηλεκτραρνητικό bit, όπως μια οκτάδα ή μια ομάδα.
Κυρίως, τα ηλεκτραρνητικά μόρια είναι είτε οξυγόνο, άζωτο ή φθόριο. Στις περισσότερες περιπτώσεις, ένα πιο ηλεκτραρνητικό άτομο με ένα μόνο ζεύγος ηλεκτρονίων ονομάζεται δέκτης.
Οι δεσμοί υδρογόνου είναι ισχυρές έλξεις μεταξύ μερικώς θετικών και θετικά φορτισμένων ατόμων. Είναι οι ισχυρότεροι από όλους τους γνωστούς τύπους δεσμών. Αυτοί οι δεσμοί βρίσκονται σε πολλά ομοιοπολικές ενώσεις αλλά είναι πιο αδύναμα από τα ομοιοπολικά.
Η ηλεκτραρνητική φύση του ατόμου του υδρογόνου συνδέει τα δύο μόρια μεταξύ τους. Το νερό μπορεί επομένως να κινηθεί μεταξύ των σωματιδίων και να σχηματίσει σταθερές χημικές ενώσεις. Για παράδειγμα, όταν τα βρεγμένα φύλλα χαρτιού κολλάνε μεταξύ τους.
Οι δεσμοί υδρογόνου εμφανίζονται μεταξύ δύο μορίων που περιέχουν τον ίδιο τύπο υδρογόνου.
Οι δεσμοί CH σχηματίζονται όταν γίνονται δύο άτομα άνθρακα ηλεκτροαρνητικότητα όριο.
Σε έναν δεσμό δότη/δέκτη, ο δότης πρωτονίων είναι το ηλεκτραρνητικό άτομο και ο δέκτης πρωτονίων είναι εκείνος που δεν είναι ομοιοπολικά συνδεδεμένος με το υδρογόνο. Τα άτομα υδρογόνου στο ζεύγος βάσεων συγκρατούνται μεταξύ τους με δεσμούς υδρογόνου.
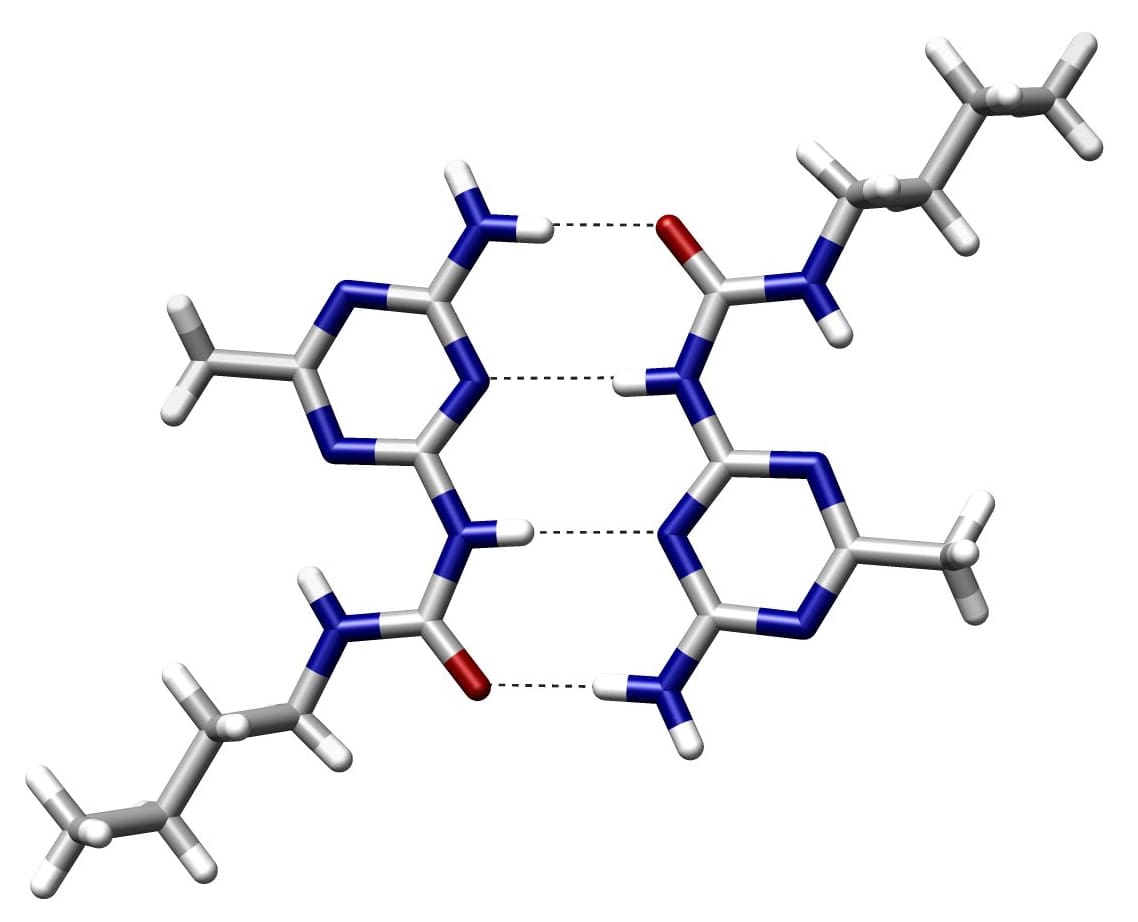
Τι είναι ο ομοιοπολικός δεσμός;
Δύο άτομα μοιράζονται ζεύγη ηλεκτρονίων για να σχηματίσουν έναν ομοιοπολικό δεσμό. Αυτά τα ζεύγη ηλεκτρονίων ονομάζονται ζεύγη δεσμών. Οι ομοιοπολικοί δεσμοί δημιουργούνται μέσω μιας ισορροπίας ελκτικών και απωστικών δυνάμεων.
Να μερικά παραδείγματα. Για παράδειγμα, εδώ είναι μια χημική εξίσωση. Διαβάστε παρακάτω για να ανακαλύψετε την επιστήμη πίσω από αυτά. Το απλούστερο παράδειγμα ομοιοπολικού δεσμού είναι η κοινή χρήση ενός ζεύγους ηλεκτρονίων.
Η διαδικασία σύνδεσης περιλαμβάνει την κοινή χρήση ηλεκτρονίων μεταξύ δύο διαφορετικών ατόμων. Επειδή τα ηλεκτρόνια μοιράζονται ενέργεια, μπορούν να έχουν χαμηλότερη ενέργεια από τα άλλα άτομα. Μπλέκονται όταν τα κέντρα έλκονται το ένα το άλλο.
«Τα κοινά ηλεκτρόνια μειώνουν την ενέργεια του άλλου ατόμου. Αυτό ονομάζεται «ισορροπία». Αυτό το φαινόμενο είναι κοινό και μπορεί να χρησιμοποιηθεί για την παρακολούθηση της προόδου και τον εντοπισμό βασικών διδαγμάτων.» Τα κοινά ηλεκτρόνια μειώνουν την ενέργεια του άλλου ατόμου. Αυτό ονομάζεται «ισορροπία». Αυτό το φαινόμενο είναι κοινό και μπορεί να χρησιμοποιηθεί για την παρακολούθηση της προόδου και τον εντοπισμό βασικών διδαγμάτων.
Η διαδικασία της κοινής χρήσης ηλεκτρονίων έχει ως αποτέλεσμα τη μείωση της ενέργειας. Το ηλεκτρόνιο που μοιράζεται ένα άτομο με ένα άλλο ηλεκτρόνιο θα χάσει ισχύ. Σε αυτή την κατάσταση σχηματίζεται ο ομοιοπολικός δεσμός.
Ένα ηλεκτρόνιο μεταξύ δύο ελκτικών κέντρων έχει μικρότερη ενέργεια από ένα ηλεκτρόνιο μεταξύ δύο ουδέτερων κέντρων. Η ισχύς ενός μεμονωμένου ατόμου αυξάνεται σε ένα μόριο εάν μοιράζεται με ένα bit με υψηλότερο επίπεδο ενέργειας.
Κύριες διαφορές μεταξύ ενός δεσμού υδρογόνου και ενός ομοιοπολικού δεσμού
- Ένας δεσμός υδρογόνου είναι μόνο 1/10 φορές ισχυρότερος από έναν ομοιοπολικό δεσμό.
- Οι δεσμοί υδρογόνου είναι ενδομοριακοί και διαμοριακοί δεσμοί. Από την άλλη πλευρά, οι ομοιοπολικοί δεσμοί είναι Διαμοριακοί χημικοί δεσμοί.
- Οι δεσμοί υδρογόνου σχηματίζονται μεταξύ δύο ατόμων δύο διαφορετικών μορίων. Μεταξύ δύο ατόμων σχηματίζονται ομοιοπολικοί δεσμοί.
- Οι δεσμοί υδρογόνου είναι δυνάμεις έλξης. Οι ομοιοπολικοί δεσμοί είναι χημικοί δεσμοί.
- Οι δεσμοί υδρογόνου έχουν χαμηλή σταθερότητα σε σύγκριση με τους ομοιοπολικούς δεσμούς.
- https://scripts.iucr.org/cgi-bin/paper?a12816
- https://pubs.acs.org/doi/pdf/10.1021/ja01130a013
- https://aip.scitation.org/doi/abs/10.1063/1.3159673
Τελευταία ενημέρωση: 29 Ιουνίου 2023

Ο Piyush Yadav έχει περάσει τα τελευταία 25 χρόνια δουλεύοντας ως φυσικός στην τοπική κοινότητα. Είναι ένας φυσικός που θέλει να κάνει την επιστήμη πιο προσιτή στους αναγνώστες μας. Είναι κάτοχος πτυχίου Φυσικών Επιστημών και Μεταπτυχιακού Διπλώματος στην Επιστήμη του Περιβάλλοντος. Μπορείτε να διαβάσετε περισσότερα για αυτόν στο δικό του βιο σελίδα.


Η επιστημονική εξήγηση είναι σαφής και ακριβής. Αυτό με βοήθησε να κατανοήσω την έννοια με καλύτερο τρόπο.
Η σύγκριση του υδρογόνου και των ομοιοπολικών δεσμών εξηγείται καλά. Υπέροχο άρθρο!
Ναι, συμφωνώ απόλυτα. Είναι ωφέλιμο για μαθητές και άλλους που ενδιαφέρονται για τη χημεία.
Αυτό το άρθρο παρέχει μια εις βάθος ανάλυση των διαφορών μεταξύ υδρογόνου και ομοιοπολικών δεσμών.
Ο συγγραφέας έχει κάνει εξαιρετική δουλειά στην εξήγηση των εννοιών με σχετικά παραδείγματα. Είναι αξιέπαινο.
Η ανάγνωση αυτού του άρθρου ήταν πραγματικά εμπλουτισμένη. Έχω αποκτήσει πολύτιμες γνώσεις και γνώσεις από τη σύγκριση που παρέχεται εδώ.
Περίμενα λίγο περισσότερα επιστημονικά στοιχεία για να υποστηρίξουν ορισμένα από τα σημεία που αναφέρθηκαν. Καλό, αλλά όχι υπέροχο.