Keemia perioodilisustabel on midagi, mida õpilastel palutakse tüütult pähe õppida, teadmata isegi selle õppimise tegelikku motiivi. Mõne inimese jaoks on see lihtsalt ainekavas sisalduv teema.
Kuid tegelikus mõttes on see väike perioodilisustabel palju olulisem kui see; see on tegevuskava, mis avab teadlastele ja teadlastele üle maailma miljon võimalust. Dmitri Mendelejev on perioodilisuse tabeli leiutaja.
Enne teda püüdsid paljud keemilisi elemente erineval viisil paigutada. Kuid Dmitri tulemus võeti vastu kogu maailmas.
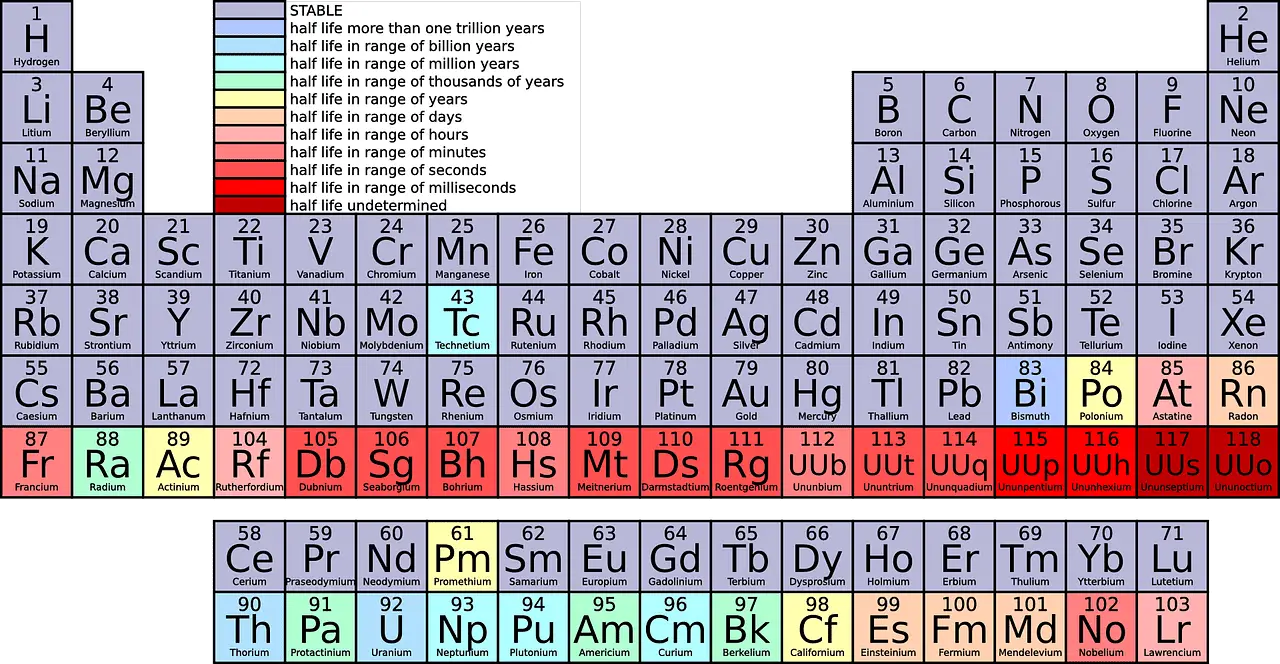
Teaduslikes lühendites nimetatakse ridu vastavalt perioodideks ja veerge rühmadeks.
Võtme tagasivõtmine
- Perioodid on perioodilisuse tabeli horisontaalsed read, mis näitavad elektronkihtide arvu elemendi aatomites, kusjuures sama perioodi elemendid on sarnase aatomistruktuuriga.
- Rühmad on perioodilisustabeli vertikaalsed veerud, mis koosnevad elementidest, mille väliskestas on sama arv elektrone, mis toob kaasa sarnased keemilised omadused.
- Nii perioodid kui ka rühmad korraldavad perioodilisuse tabeli elemente, kusjuures perioodid tähistavad horisontaalseid ridu, mis põhinevad elektronkihtidel ja rühmad, mis esindavad vertikaalseid veerge väliskihi elektronide ja keemiliste omaduste alusel.
Periood vs rühm
Periood on horisontaalne rida, mis kulgeb perioodilisuse tabeli vasakult küljelt paremale ja elektronegatiivsus suureneb üle selle. Rühm on vertikaal veerg mis läheb perioodilise tabeli ülaosast alla ja elektronegatiivsus suureneb alt üles.

Korraldamise ajaks jättis Mendelejev paar rida tühjaks muljega, et lähiajal tuleb sisse veel mõni element. Ja üllataval kombel oli üks element, mis sellesse vahesse sobis gallium.
Võrdlustabel
| Võrdluse parameeter | Periood | Grupp |
|---|---|---|
| Eestvedamine | Perioodid on kaasaegse perioodilisuse tabeli horisontaalsed read | Rühmad on vertikaalsed veerud, mis jooksevad läbi perioodilise tabeli ülaosa |
| Kinnisvara | Perioodi elementidel ei ole sarnaseid omadusi. | Iga rühma elementidel on mõned sarnased omadused, kuid mitte identsed. |
| Sarnasus | Sama perioodi elementidel on võrdne arv elektronide koostist | Iga rühma elementidel on võrdne arv valentselektrone |
| Summa | Perioodilises tabelis on 7 perioodi | Rühm sisaldab 18 elementi, mis on paigutatud kaasaegses perioodilisuse tabelis vertikaalselt. |
| Elektronegatiivsus | See suureneb vasakult paremale. | See suureneb rühmas alt üles. |
Mis on Periood?
Periood on perioodilisustabeli horisontaalne rida vasakust äärmisest parempoolsesse serva. Praeguse seisuga on perioodilisuse tabelis 7 perioodi.
Algab uus periood, kui elektronidega lisandub uus fundamentaalne energiatase. Igal elemendil perioodis on tõenäoliselt võrdne arv aatomiorbitaale.
Näiteks – iga element 1st perioodil on ainult 1 orbiidi oma elektronide jaoks 2nd periood sisaldab elektronide jaoks 2 orbitaali. Samamoodi kasvavad orbitaalid reas allapoole liikudes.
Elemendi suurus väheneb, kui liigute perioodi jooksul, kuna elektronkihtide arv jääb muutumatuks, kuid prootonite arv tuumas tõuseb. Seetõttu muutub aatom raskemaks, kuid selle suurus väheneb.
Vaadates perioodilisustabelit, näete igasse rida erinevaid elemente. 1. perioodil on ainult 2 elementi (1 ja 18), 2. ja 3. periood on kumbki 8 elementi, 4. ja 5. periood on 18 ning 6. ja 7. periood vastavalt 32 elementi.
Mis on grupp?
Ülevalt alla lugedes on perioodilisustabelis 18 rühma. Kõikidele rühmadele on määratud erinevad nimed.
Rühmad on metallide, mittemetallide ja poolmetallide segakategooriad, mis on rühmitatud perekondadesse nende sarnaste omaduste järgi. Näiteks rühm 1 kuulub liitiumi perekonda, mis on klassifitseeritud alkeenmetallideks.
Samamoodi on igal rajal oleval rühmal oma perekonnanimi. Seotud rühma elementidel on sarnased tunnused, kuna nende äärepoolseimates kestades on sama elektronide arv.
Elemendi suurus suureneb, kui liigutate mis tahes rühma allapoole. Selle põhjuseks on asjaolu, et tuumas on suur hulk prootoneid ja neutroneid.
Lisaks muudab täiendav elektronkiht aatomi raskemaks. Rühmade puhul on elementide illustreerimiseks kaks erinevat viisi.
Mõlema nummerdamissüsteemi mõistmine on oluline, kuna perioodilisustabel kuvatakse mõlemas vormingus. Ameerika Ühendriikides kasutasid nad rühma iga elemendi tähistamiseks tähti A&B, kuid kahjuks täheldati seda kui korrastamata numeratsioonisüsteemi.
Et kõrvaldada kõikvõimalik segadus, International Liit Pure and Applied Chemistry (IUPAC) tuli ideele nummerdada elemendid kujul (1,2, 3…18). Siiski on vastuvõetavad mõlemad nummerdamissüsteemid. Kuid IUPACi nummerdamine tundub hästi organiseeritud ja arusaadav.
Peamised erinevused Periood ja rühm
- Asukoht: Grupid on perioodilisuse tabeli püstised veerud, perioodid aga sirged read.
- number: Perioodilises tabelis on kokku 18 gruppi ja 7 perioodi, mille hulgas on rühmad liigitatud erinevate perekondade ja metallitüüpide alla.
- Keemilised omadused: Kõigil rühma elementidel on analoogsed keemilised või füüsikalised omadused, samas kui perioodidel on sama elektronide hierarhia.
- Energiatase: Kui me liigume rühmas ülalt alla, suureneb elektronide energiatase. Teisest küljest jääb elektronide energiatase igal perioodil samaks.
- Elektronegatiivsus: See langeb rühmas ülalt alla ja tõuseb perioodi jooksul vasakult paremale. See on perioodilise tabeli uurimisel oluline kaalutlus.

Viimati värskendatud: 11. juunil 2023

Piyush Yadav on viimased 25 aastat töötanud kohalikus kogukonnas füüsikuna. Ta on füüsik, kelle kirg on muuta teadus meie lugejatele kättesaadavamaks. Tal on loodusteaduste bakalaureusekraad ja keskkonnateaduste magistrikraad. Tema kohta saate tema kohta rohkem lugeda bio-leht.

Suurepärane artikkel! See annab suurepärase ülevaate perioodilisuse tabeli tähtsusest. Ma tõesti nautisin seda!
Mul on väga hea meel, et leidsite sellest abi. Mina tegin ka!
Seda peaks kindlasti lugema iga loodusteaduste üliõpilane.
Väga informatiivne postitus. Peaksime taotlema paremat haridust ja teadusteemade mõistmist.
See on täpselt see, mida me vajame.
See on lihtsalt järjekordne näide aegunud haridusstandarditest. Peaksime õpilastele rohkem asjakohaseid teemasid õpetama.
Usun, et õpilaste jaoks on perioodilisuse tabeli mõistmine ülioluline.
See on vastuoluline seisukoht, Joel.
Ma arvan, et inimesed alahindavad perioodilisuse tabeli väärtust. Peaksime selle õpetamise täiustamiseks rohkem tegema.
See on kindlasti oluline punkt.
Minu meelest on tõesti huvitav, et selline pealtnäha lihtne tabel mahutab nii palju väärtuslikku teavet.
Jah, see on päris põnev.
See on valgustav. Perioodilisustabel on alahinnatud.
See oli minu päeva alustamiseks väga vajalik lugemine!
Siin on mõned kehtivad punktid, kuid ma pole ikka veel veendunud perioodilisuse tabeli tähtsuses.
Nõustun sinuga, Zach.
Perioodilisustabel on keemia nurgakivi ja seda tuleks sellisena käsitleda.
Ma ei saanud rohkem nõus olla.
Ma ei nõustu, usun, et perioodilisustabeli õpetamine praegusel viisil on aegunud ja tuleks üle vaadata.
Ma saan aru, miks mõnele võib see aegunud olla, kuid see on teaduse arengu jaoks väga oluline.
Ma näen, mida sa räägid, kuid ma ei ole täielikult nõus.
Kuigi ma mõistan perioodilisuse tabeli tähtsust, on raske väita, et praegune haridussüsteem on piisav.
Sa tõstatad olulise punkti, Erin.