Organische verbindingen die functionele amine- en carboxylgroepen bevatten, worden aminozuren genoemd. Elk aminozuur heeft een specifieke zijketen, waardoor het uniek is.
De primaire elementen van elk aminozuur omvatten koolstof, zuurstof, waterstof en stikstof, samen met de elementen die in de zijketen van het betreffende aminozuur worden aangetroffen.
Polypeptiden en eiwitten zijn twee van de belangrijkste polymeren van aminozuren. Zowel polypeptiden als eiwitten zijn aanwezig in biologische systemen.
Wanneer verschillende aminozuren aan elkaar zijn gekoppeld met behulp van peptidebindingen (een covalente binding die ontstaat door de condensatie van twee aminozuren waarbij een water molecuul), vindt polymerisatie plaats om polypeptiden en eiwitten te vormen.
Key Takeaways
- Een polypeptide is een keten van aminozuren die met elkaar zijn verbonden door peptidebindingen, terwijl een eiwit een complex molecuul is dat bestaat uit een of meer polypeptideketens.
- Polypeptiden zijn korter en eenvoudiger dan eiwitten en kunnen functioneren als hormonen, enzymen of structurele componenten in het lichaam.
- Eiwitten zijn groter en complexer dan polypeptiden en ze hebben een breed scala aan lichaamsfuncties, waaronder het katalyseren van chemische reacties, het transporteren van moleculen en het bieden van structurele ondersteuning.
Polypeptide versus eiwit
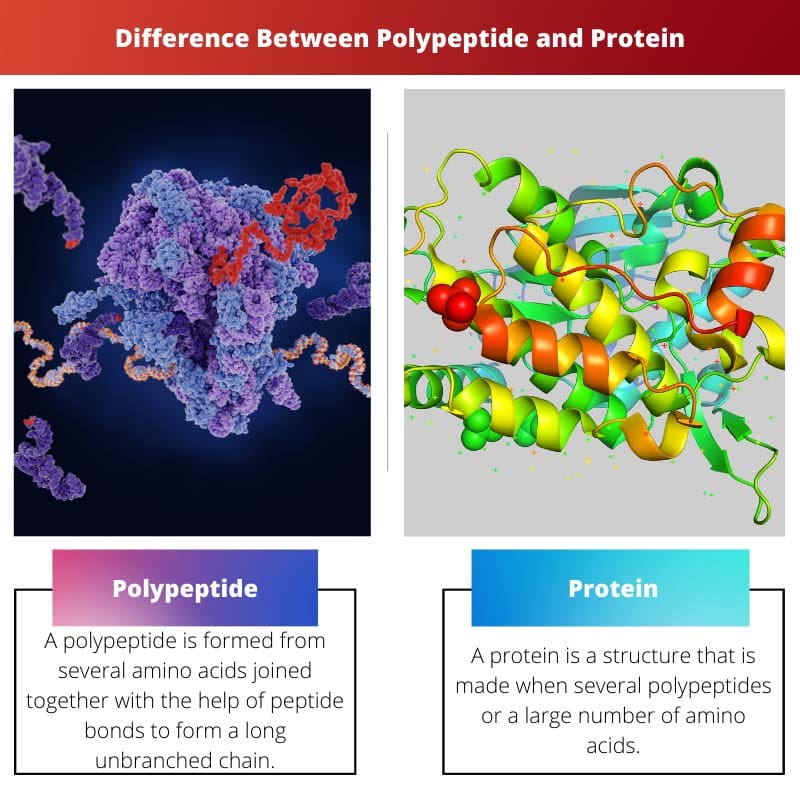
Polypeptide en eiwit verschillen omdat polypeptide afkomstig is van lange aminozuurketens. Eiwitten worden gevormd uit twee of meer polypeptideketens. Daarom is het gemakkelijk op te merken dat polypeptiden een lager molecuulgewicht hebben dan eiwitten.
Vergelijkingstabel
| Parameter van vergelijking | polypeptiden | Eiwit |
|---|---|---|
| Fundamentele definitie | Een polypeptide wordt gevormd uit verschillende aminozuren die met behulp van peptidebindingen met elkaar zijn verbonden om een lange onvertakte keten te vormen. | Een eiwit is een structuur die wordt gemaakt wanneer er meerdere polypeptiden of een groot aantal aminozuren bestaan. |
| moleculair gewicht | Polypeptiden hebben een lager molecuulgewicht dan eiwitten. | Het molecuulgewicht van een eiwit is hoger dan dat van het polypeptide. |
| Structuur Betekenis | Het betekent de primaire structuur van het eiwit. | Het kan bestaan als secundaire, tertiaire en quaternaire structuren. |
| Inclusief Obligaties | Het bevat peptidebindingen. | Eiwitten omvatten peptidebindingen, ionische bindingen, disulfidebindingen en Van der Waal-aantrekking. |
| Functie | Het fungeert als bouwsteen voor eiwitten. | Eiwitten nemen deel aan verschillende belangrijke metabolische reacties vanwege de stabiele vorm die ze geschikt maakt voor specifieke binding aan een bepaald ligand. |
Wat is polypeptide?
Polypeptiden worden gevormd wanneer peptidebindingen worden gevormd om lange ketens van aminozuren te vormen. Een peptidebinding wordt gevormd wanneer twee aminozuren reageren om één water te condenseren molecuul(H2O).
Korte en vertakte ketens van aminozuren worden peptiden genoemd. Deze bevatten 20 tot 30 aminozuren.
Wanneer het aantal aminozuren in de keten verder toeneemt, worden er polypeptiden gevormd. Aan elk polypeptide is een specifieke reeks aminozuren gekoppeld.
Polypeptiden kunnen tot 4000 aminozuren in die keten bevatten. Deze worden gekenmerkt door een polypeptideruggengraat gevormd door de continue reputatie van de sequentie van atomen in de kern van de keten.
Een specifieke zijketen is opgenomen in de polypeptideruggengraat die overeenkomt met de geselecteerde aminozuren.
De belangrijkste functie van polypeptiden is dat ze fungeren als de bouwsteen voor het vormen van eiwitten. Daarom worden ze ook wel de primaire structuur van het eiwit genoemd.

Wat is eiwit?
Eiwitten hebben biologisch gezien verschillende functies. Dit zijn zowel functioneel als structureel complexe moleculen die worden gecreëerd door een groot aantal aminozuren die samenkomen.
Aminozuren binden zich om polypeptideketens te vormen die samen een eiwit vormen.
De functies van eiwitten zijn voornamelijk te danken aan hun structuur en vorm, waardoor ze geschikt zijn om fysiek te interageren met verschillende moleculen.
De betrokken interacties zijn zeer selectief en specifiek. Eiwitten binden zich met hun ligandbindingsplaatsen aan zeer specifieke moleculen die daarmee geassocieerd zijn, liganden genoemd.
De bindingsplaats voor het ligand is een bijzonder gevormde holte op het oppervlak van het eiwit die wordt gevormd als gevolg van het vouwen van verschillende polypeptideketens.
Elke dergelijke holte heeft een ander ligand om mee te interageren. Verandering in één aminozuur kan zijn vorm veranderen en de functie van dat eiwit verstoren.
Eiwitten zijn te vinden met 4 verschillende niveaus van structurele organisatie:
- Primaire structuur: Een eenvoudige lange polypeptideketen is de primaire structuur van het eiwit.
- Secundaire structuur: het wordt ook wel de alfa-helixstructuur genoemd en is spiraalvormig en goed geordend. Soms worden deze ook gevonden in de vorm van anti-parallelle beta-geplooide lakens.
- Tertiaire structuur: deze worden gevormd door reacties van polypeptideketens via disulfidebindingen, Van der Waal-bindingen, waterstofbruggen en ionische bindingen.
- Quaternaire structuur: Het is samengesteld uit verschillende polypeptiden.
Belangrijkste verschillen tussen polypeptide en eiwit
- Het fundamentele verschil tussen polypeptide en eiwit is dat het polypeptide wordt gevormd uit Sagar-aminozuren die samenkomen via peptidebindingen. Een eiwitstructuur wordt daarentegen gemaakt wanneer veel polypeptideketens samenkomen.
- Polypeptiden hebben een molecuulgewicht dat veel lager is dan dat van eiwitten. Wanneer er polypeptiden worden gevonden die meer dan honderd aminozuren bevatten, worden ze beschouwd als eiwitten met een molecuulmassa van meer dan 10,000.
- De structuur van een polypeptide is een lange onvertakte keten van aminozuren. Aan de andere kant bestaan eiwitten in secundaire, tertiaire en quaternaire structurele organisaties.
- De binding in polypeptideketens is een peptidebinding. Eiwitten bevatten daarentegen verschillende bindingen zoals ionische bindingen, disulfidebindingen, peptidebindingen en Van der Waal-attracties.
- De basisfunctionaliteit van een polypeptide is dat het fungeert als de bouwsteen voor eiwitten, terwijl de functionaliteiten van eiwitten zeer complex zijn vanwege hun stabiele vorm en structuur. Holtes die op het oppervlak van de eiwitten worden aangetroffen als gevolg van het vouwen van polypeptideketens, maken ze geschikt voor verschillende specifieke reacties met een specifiek ligand.
- https://patents.google.com/patent/US6194551B1/en
- https://www.sciencedirect.com/science/article/pii/096800049290005T
Laatst bijgewerkt: 11 juni 2023

Piyush Yadav heeft de afgelopen 25 jaar als natuurkundige in de lokale gemeenschap gewerkt. Hij is een natuurkundige die gepassioneerd is om wetenschap toegankelijker te maken voor onze lezers. Hij heeft een BSc in natuurwetenschappen en een postdoctoraal diploma in milieuwetenschappen. Je kunt meer over hem lezen op zijn bio pagina.

De vergelijkingstabel is erg handig, het maakt het gemakkelijk om de verschillen te begrijpen
Akkoord, het visuele hulpmiddel is nuttig
De uitsplitsing van de belangrijkste verschillen tussen polypeptide en eiwit is uitzonderlijk
Akkoord
Ik vond de informatie behoorlijk verhelderend
Ik ook, leuk om te lezen
Ik vind het zeer grondig, geweldig werk
Dit is zeer basale informatie, ik had iets diepgaanders verwacht
De uitleg van de primaire en secundaire structuur was erg interessant
Ik ben het ermee eens dat het structurele organisatiegedeelte goed werd uitgelegd
Dit is een geweldige uitleg! Zo duidelijk en gemakkelijk te begrijpen
Ik dacht hetzelfde!
De hele uitleg van de aminozuren was geweldig
Ja, een zeer grondige uitleg
Ik ben het eens
De uitleg van de primaire en secundaire eiwitstructuur was fantastisch
Mee eens, geweldige post
Had het niet beter kunnen zeggen
Ik waardeer de gedetailleerde uitleg over de verschillen tussen polypeptide en eiwit
Ja, het was heel duidelijk
Het onderwerp is interessant, maar de informatie is te basaal voor mijn kennisniveau
Ik ben het ermee eens, meer geavanceerde inhoud zou op prijs worden gesteld
Ik ben bang dat dit geen goede uitleg over dit onderwerp is