U kemiji različiti spojevi nastaju različitim vrstama veza između molekula.
Različiti čimbenici određuju kakvu vrstu veze treba stvoriti između različitih molekula, a vrsta molekule igra veliku ulogu u stvaranju takvih veza.
Veza je privlačna sila koja djeluje između dvije molekule.
Ključni za poneti
- Ionske veze nastaju između metala i nemetala prijenosom elektrona, dok se kovalentne veze stvaraju između nemetala dijeljenjem elektrona.
- Ionski spojevi imaju visoka tališta i vrelišta, dok kovalentni spojevi imaju niža tališta i vrelišta.
- Ionski spojevi provode struju kada su otopljeni u vodi ili otopljeni, ali kovalentni spojevi ne.
Ionske veze protiv kovalentne veze
Ionske veze nastaju između atoma prijenosom elektrona, stvarajući ione koji se međusobno privlače zbog svojih suprotnih naboja. Kovalentne veze uključuju dijeljenje elektrona između atoma, stvarajući međusobno privlačenje koje drži atome zajedno.
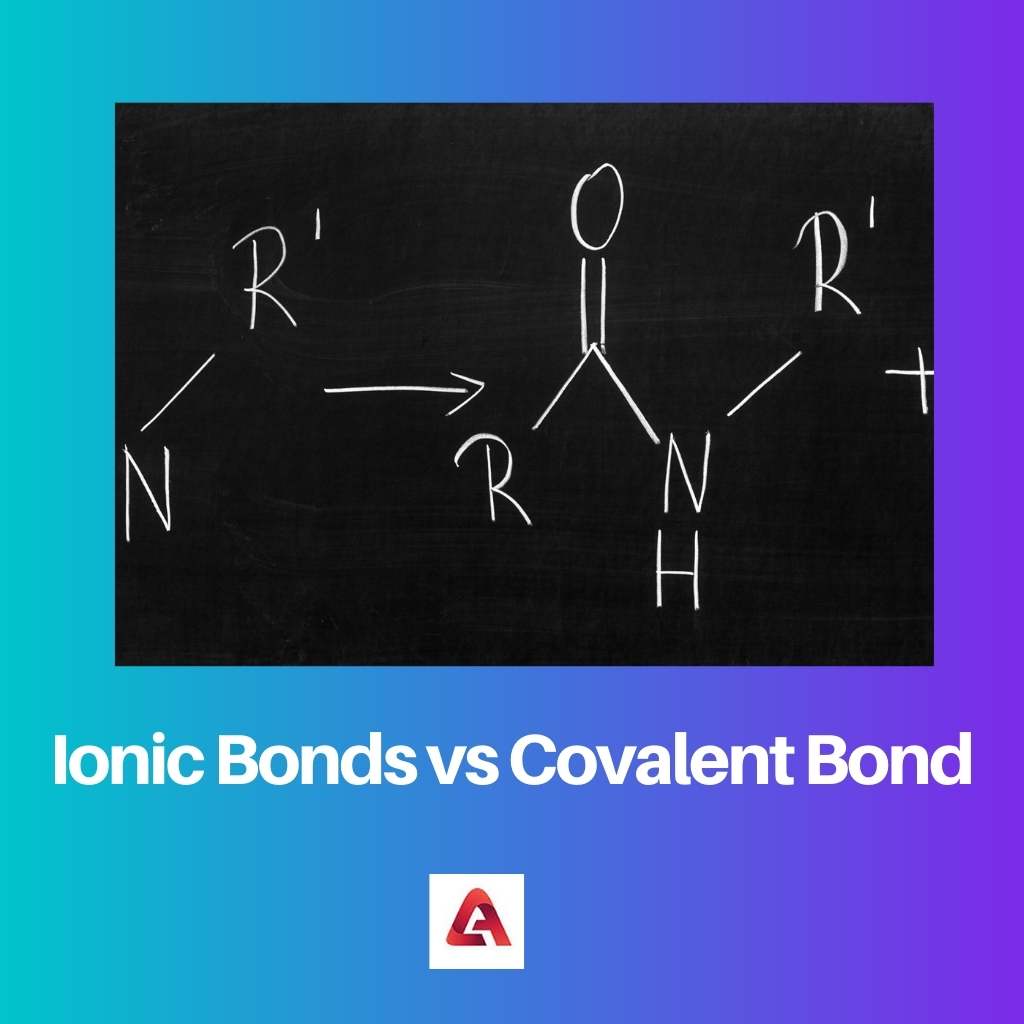
U slučaju ionskih spojeva nastaje ionska veza. Ionski spojevi sastoje se od molekula koje sadrže nabijene ione, koji mogu biti pozitivno ili negativno nabijeni.
Stoga ovo stvara privlačnu silu između molekula jer se suprotni naboji međusobno privlače. Ova sila privlačenja rezultira stvaranjem veze.
Između nemetala stvaraju se kovalentne veze. Ova vrsta veze nastaje zbog dijeljenja elektrona između dvije molekule.
Kako jedna od molekula u kovalentnom spoju ima manjak elektrona, ona prima potreban broj elektrona od donorskih molekula kako bi stvorila stabilan kovalentni spoj.
Tabela za usporedbu
| Parametri usporedbe | Ionska veza | Kovalentna veza |
|---|---|---|
| Stvaranje | Ionske veze nastaju zbog prijenosa iona između molekula | Kovalentne veze nastaju zbog dijeljenja elektrona između dvije molekule |
| Stanje spoja | Nastali spojevi prisutni su samo u čvrstom stanju | Nastali spojevi prisutni su u svim agregatnim stanjima |
| Vrsta molekula | Veza se javlja između metala i nemetala | Veza se javlja između dva nemetala |
| Polaritet | Ionski spojevi su nepolarni | Kovalentni spojevi su polarni |
| Talište | Ionski spojevi imaju viša tališta | Kovalentni spojevi imaju niže talište |
Što je ionska veza?
Ionska veza jedna je od tri vrste veza koje se javljaju između molekula, tvoreći ionski spoj.
Veza se javlja između metala i nemetala, a jedan od najčešćih primjera takvog spoja je sol (NaCl), u kojoj je natrij (Na) metal, a klor (Cl) nemetal.
To je jaka veza i ne može se tako lako prekinuti kao u slučaju kovalentnih veza. Veza nastaje zbog dijeljenja elektrona između metala i nemetala.
Jedna od molekula u ionskom spoju ima manjak elektrona, dok je druga molekula bogata elektronima, što stvara privlačnu silu između dviju molekula.
Elektrostatska sila privlačenja rezultira međudjelovanjem između dviju molekula, dijeleći elektrone od atoma bogatog elektronima do atoma s nedostatkom elektrona.
Atom ili molekula donor potpuno prenosi atom na molekulu ili atom primatelja, što rezultira snažnom i čistom vezom između dviju molekula.
Karakteristike takvih ionskih spojeva su njihova visoka tališta i visoka električna vodljivost u rastaljenom ili otopljenom stanju. Ionski spojevi također su visoko topljivi u vodi.

Što je kovalentna veza?
Kovalentna veza je vrsta kemijske veze između molekula koja dovodi do stvaranja kovalentnog spoja.
To je najslabija od tri vrste kemijskih veza, a molekule u kovalentnom spoju mogu se lako odvojiti.
Kovalentne veze nastaju između dva nemetala, a veza metala molekula ovisi o broju elektrona valentne ljuske.
Do povezivanja dolazi dijeljenjem elektronskih parova, a to dijeljenje elektrona događa se radi održavanja kemijske ravnoteže između molekula ili atoma.
Dijeljenje elektrona između dvije nestabilne molekule stvara stabilnu valentnu ljusku u obje molekule.
Kada oba atoma dostignu svoje puno valentno stanje, između dva atoma ili molekule nastaje veza.
Zajednički par elektrona prisutan je između oba atoma kako bi se održala stabilnost spoja.
Najčešći primjer kovalentne veze je između dva atoma vodika u molekuli H2.
U molekuli H2, dva atoma vodika dijele dva elektrona što dovodi do kovalentne veze.
Ključni čimbenik potreban za stvaranje kovalentne veze je elektronegativnost molekula. Dva atoma sa sličnim elektronegativnostima rezultiraju kovalentnom vezom.

Glavne razlike između ionske i kovalentne veze
- Ionske veze nastaju zbog prijenosa iona između molekula. Kovalentne veze nastaju zbog dijeljenja elektrona među atomima.
- Ionski spojevi prisutni su samo u čvrstom stanju. Kovalentni spojevi prisutni su u svim agregatnim stanjima.
- Između metala i nemetala nastaje ionska veza. Kovalentna veza nastaje između dva nemetala.
- Ionski spojevi su nepolarni, dok su kovalentni spojevi polarni
- Ionski spojevi imaju vrlo visoka tališta, dok kovalentni spojevi imaju niska tališta.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Zadnje ažuriranje: 14. lipnja 2023

Piyush Yadav proveo je posljednjih 25 godina radeći kao fizičar u lokalnoj zajednici. On je fizičar koji strastveno želi učiniti znanost dostupnijom našim čitateljima. Posjeduje diplomu prirodnih znanosti i poslijediplomski studij znanosti o okolišu. Više o njemu možete pročitati na njegovom bio stranica.

Fascinantne informacije o ionskim i kovalentnim vezama, količina detaljnih informacija u članku je izvanredna i vrlo lako razumljiva
Zanimljiv članak. Cijenim detaljnu raspravu o karakteristikama ionskih i kovalentnih spojeva.
Ne slažem se. Kovalentne veze nisu nužno najslabije od tri vrste kemijskih veza. Postoje slučajevi u kojima su jače od ionskih veza.
To je točno u određenim okolnostima, ali općenito, izjava vrijedi. Kovalentne veze smatraju se najslabijima zbog lakoće prekidanja veze.
Izvrsno objašnjenje ionskih i kovalentnih veza. Radujem se čitanju više od ovog autora.
Da, post je bio vrlo informativan i lako razumljiv. Cijenim usporednu tablicu koja sažima razlike između dvije vrste obveznica.
Ovaj članak pojednostavljuje temu, ali čini se da postoji ozbiljan nedostatak referenciranja podataka. Više vjerodostojnosti može se dati ispravnim citatima
Slažem se. Provjerio sam navedene reference i oni su vjerodostojni izvori.
Informacija mi je bila vrlo korisna, posebno za moj nadolazeći ispit iz kemije
Čini se da je autor vrlo upućen u kemiju. Uživam čitati detaljne postove poput ovog.
Dogovoren. Usporedna tablica je od velike pomoći u isticanju razlika između ionskih i kovalentnih veza.
U članku se objašnjavaju teme koje su vrlo korisne za uvodno učenje.
Ovaj post pruža opsežan pregled ionskih i kovalentnih veza. Primjeri su od velike pomoći u razumijevanju pojmova.
Adekvatne informacije koje su vrijedne u obrazovne svrhe. Obavezna lektira za srednjoškolce
Usporedna tablica izvrstan je način ilustracije razlika, za svakoga tko ima osnovno znanje o kemiji ovaj bi članak mogao biti prekrasan izvor
Slažem se. Ključni zaključci također su vrlo korisni i pojednostavljuju koncepte.
U članku su jasno prikazane razlike između ionske i kovalentne veze. Smatrao sam ga vrlo korisnim.