Em Química, diferentes compostos são formados por diferentes tipos de ligações entre as moléculas.
Vários fatores determinam que tipo de ligação deve ser formada entre diferentes moléculas, e o tipo de molécula desempenha um papel importante na formação de tais ligações.
Uma ligação é uma força atrativa que atua entre duas moléculas.
Principais lições
- As ligações iônicas se formam entre metais e não metais através da transferência de elétrons, enquanto as ligações covalentes se formam entre não metais através do compartilhamento de elétrons.
- Os compostos iônicos têm pontos de fusão e ebulição elevados, enquanto os compostos covalentes têm pontos de fusão e ebulição mais baixos.
- Os compostos iônicos conduzem eletricidade quando dissolvidos em água ou fundidos, mas os compostos covalentes não.
Ligações Iônicas x Ligações Covalentes
As ligações iônicas são formadas entre os átomos através da transferência de elétrons, criando íons que são atraídos uns pelos outros devido às suas cargas opostas. As ligações covalentes envolvem o compartilhamento de elétrons entre os átomos, criando uma atração mútua que mantém os átomos juntos.
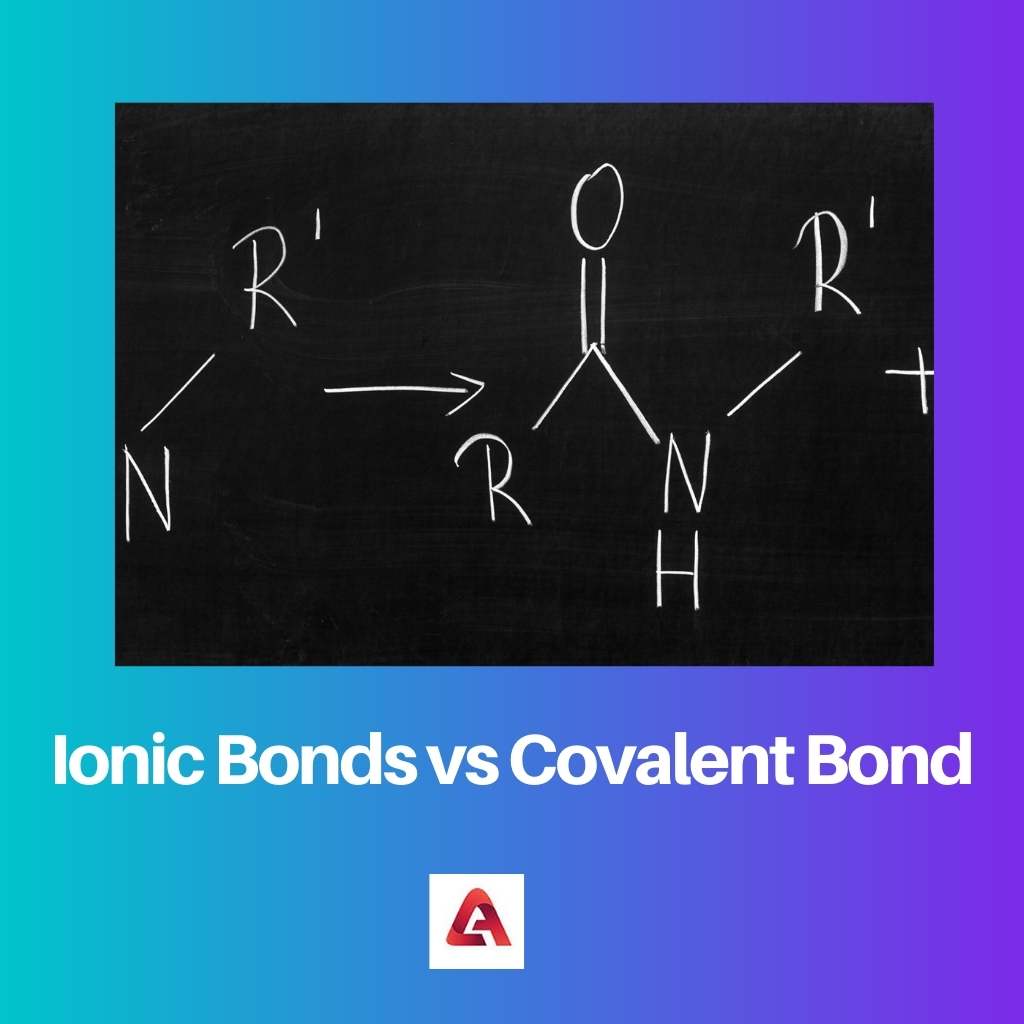
Uma ligação iônica é formada no caso de compostos iônicos. Compostos iônicos são feitos de moléculas contendo íons carregados, que podem ser carregados positivamente ou negativamente.
Assim, isso cria uma força de atração entre as moléculas, pois cargas opostas se atraem. Essa força de atração resulta na formação do vínculo.
As ligações covalentes são formadas entre não metais. Este tipo de ligação é formado devido ao compartilhamento de elétrons entre duas moléculas.
Como uma das moléculas em um composto covalente é deficiente em elétrons, ela recebe o número necessário de elétrons das moléculas doadoras para criar um composto covalente estável.
Tabela de comparação
| Parâmetros de comparação | Ligação iônica | Ligação covalente |
|---|---|---|
| Criação | As ligações iônicas são formadas devido à transferência de íons entre as moléculas | As ligações covalentes são formadas devido ao compartilhamento de elétrons entre duas moléculas |
| Estado do composto | Os compostos formados estão presentes apenas no estado sólido | Os compostos formados estão presentes em todos os estados da matéria |
| Tipo de moléculas | A ligação ocorre entre um metal e um ametal | A ligação ocorre entre dois não metais |
| Polaridade | Compostos iônicos são apolares | Compostos covalentes são polares |
| Ponto de fusão | Compostos iônicos têm pontos de fusão mais altos | Compostos covalentes têm pontos de fusão mais baixos |
O que é ligação iônica?
Uma ligação iônica é um dos três tipos de ligações que ocorrem entre as moléculas, formando um composto iônico.
A ligação ocorre entre um metal e um ametal, e um dos exemplos mais comuns de tal composto é o sal (NaCl), no qual o Sódio (Na) é um metal e o Cloro (Cl) é um ametal.
É uma ligação forte e não pode ser quebrada tão facilmente quanto no caso das ligações covalentes. A ligação ocorre devido ao compartilhamento de elétrons entre o metal e o ametal.
Uma das moléculas em um composto iônico é deficiente em elétrons, enquanto a outra molécula é rica em elétrons, criando uma força de atração entre as duas moléculas.
A força eletrostática de atração resulta na interação entre as duas moléculas, compartilhando elétrons do átomo rico em elétrons para o átomo deficiente em elétrons.
O átomo ou molécula doadora transfere completamente o átomo para a molécula ou átomo receptor, resultando em uma ligação forte e limpa entre as duas moléculas.
As características desses compostos iônicos são seus altos pontos de fusão e alta condutividade elétrica no estado fundido ou dissolvido. Compostos iônicos também são altamente solúveis em água.

O que é ligação covalente?
Uma ligação covalente é um tipo de ligação química entre moléculas que leva à formação de um composto covalente.
É o mais fraco dos três tipos de ligações químicas, e as moléculas em um composto covalente podem ser facilmente separadas.
As ligações covalentes são formadas entre dois não-metais, e a ligação de metais de moléculas depende do número de camadas de valência de elétrons.
A ligação ocorre pelo compartilhamento de pares de elétrons, e esse compartilhamento de elétrons ocorre para manter o equilíbrio químico entre as moléculas ou átomos.
O compartilhamento de elétrons entre duas moléculas instáveis cria uma camada de valência estável em ambas as moléculas.
Quando ambos os átomos atingiram seu estado de valência total, uma ligação é formada entre os dois átomos ou moléculas.
O par compartilhado de elétrons está presente entre ambos os átomos para manter a estabilidade do composto.
O exemplo mais comum de uma ligação covalente é entre os dois átomos de hidrogênio em uma molécula de H2.
Em uma molécula de H2, os dois átomos de hidrogênio compartilham dois elétrons, levando a uma ligação covalente.
O fator chave necessário para a formação de uma ligação covalente é a eletronegatividade das moléculas. Dois átomos com eletronegatividades semelhantes resultam em uma ligação covalente.

Principais diferenças entre ligação iônica e covalente
- As ligações iônicas são formadas devido à transferência de íons entre as moléculas. As ligações covalentes são formadas devido ao compartilhamento de elétrons entre os átomos.
- Compostos iônicos estão presentes apenas no estado sólido. Compostos covalentes estão presentes em todos os estados da matéria.
- Uma ligação iônica é formada entre um metal e um ametal. Uma ligação covalente é formada entre dois não metais.
- Os compostos iônicos são apolares, enquanto os compostos covalentes são polares.
- Os compostos iônicos têm pontos de fusão muito altos, enquanto os compostos covalentes têm pontos de fusão baixos.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Última atualização: 14 de junho de 2023

Piyush Yadav passou os últimos 25 anos trabalhando como físico na comunidade local. Ele é um físico apaixonado por tornar a ciência mais acessível aos nossos leitores. Ele é bacharel em Ciências Naturais e pós-graduado em Ciências Ambientais. Você pode ler mais sobre ele em seu página bio.

Informações fascinantes sobre ligações iônicas e covalentes, a quantidade de informações detalhadas no artigo é notável e muito fácil de entender
Artigo interessante. Agradeço a discussão aprofundada sobre as características dos compostos iônicos e covalentes.
Discordo. As ligações covalentes não são necessariamente as mais fracas dos três tipos de ligações químicas. Há casos em que são mais fortes que as ligações iônicas.
Isso é verdade em certas circunstâncias, mas geralmente a afirmação é válida. As ligações covalentes são consideradas mais fracas devido à facilidade de quebra da ligação.
Excelente explicação sobre ligações iônicas e covalentes. Estou ansioso para ler mais deste autor.
Sim, o post foi muito informativo e fácil de entender. Agradeço a tabela de comparação para resumir as diferenças entre os dois tipos de títulos.
Este artigo simplifica o tópico, mas parece haver uma grave falta de referência de dados. Mais credibilidade pode ser dada com citações adequadas
Concordo. Verifiquei as referências fornecidas e são fontes confiáveis.
Achei as informações muito úteis, especialmente para meu próximo exame de química
O autor parece ter muito conhecimento quando se trata de Química. Gosto de ler postagens detalhadas como esta.
Acordado. A tabela de comparação é muito útil para destacar as distinções entre ligações iônicas e covalentes.
O artigo explica os tópicos que são muito úteis para o aprendizado introdutório.
Esta postagem fornece uma visão geral abrangente das ligações iônicas e covalentes. Os exemplos são muito úteis para a compreensão dos conceitos.
Informações adequadas que sejam valiosas para fins educacionais. Leitura obrigatória para estudantes do ensino médio
A tabela de comparação é uma ótima maneira de ilustrar as diferenças. Para qualquer pessoa com conhecimentos básicos de química, este artigo pode ser um recurso maravilhoso.
Concordo. As principais conclusões também são bastante úteis e simplificam os conceitos.
O artigo apresenta claramente as diferenças entre ligações iônicas e covalentes. Eu achei muito útil.