Mezi kovalentní a uhlovodíkovou vazbou existuje mnoho zásadních rozdílů. Chemie, nauka o látkách – prvcích a sloučeninách, začíná základy vazeb mezi dvěma atomy a molekulami.
Tento článek vysvětlí rozdíly mezi vodíkovými a kovalentními vazbami a jak se tvoří. Podíváme se na dva typy chemických vazeb. Typ interakce odlišuje kovalentní molekulu od molekuly uhlovodíku.
Key Takeaways
- Vodíkové vazby se tvoří mezi molekulami, když se atom vodíku váže k vysoce elektronegativnímu atomu; kovalentní vazby sdílejí elektrony mezi atomy v molekule.
- Vodíkové vazby jsou slabší než vazby kovalentní a poskytují dočasné a reverzibilní interakce.
- Vodíkové vazby přispívají ke struktuře a funkci biologických molekul; kovalentní vazby tvoří základ molekulárních struktur.
Vodíková vazba vs kovalentní vazba
Vodíkové vazby vznikají, když kladně nabitý atom vodíku interaguje s elektronegativním atomem a vytváří relativně slabší vazbu než kovalentní vazby, které zahrnují sdílení elektronů. Tyto vazby jsou nezbytné pro jedinečné vlastnosti vody. Kovalentní vazby tvoří základ většiny molekul.

Vodíková vazba může být buď intramolekulární, nebo intermolekulární. Energie spojená s vodíkovou vazbou se mění v závislosti na geometrii a prostředí atomů.
Je to slabší vazba než van der Waalsova interakce, vyskytující se v organických a anorganických molekulách. Některé příklady vodíkových vazeb jsou kyselina salicylová, H2O (voda), methylalkohol, cukr atd.
Kovalentní vazby jsou formy mezimolekulárních sil. Vznikají, když dva nebo více atomů sdílí své elektrony, aby naplnily své nejvzdálenější elektronové obaly. Kovalentní vazby jsou mnohem pevnější než vodíkové vazby a mají vysokou stabilitu.
Srovnávací tabulka
| Parametry srovnání | Vodíková vazba | Kovalentní vazba |
|---|---|---|
| Co jsou? | Vodíková vazba je přitažlivá síla mezi atomem vodíku a více elektronegativním atomem. | Kovalentní vazby jsou chemické vazby vzniklé sdílením elektronů. |
| Síly | Mezimolekulární a intramolekulární síly. | Mezimolekulární síly. |
| Pevnost | Vzniká mezi dvěma atomy. | Kovalentní vazby jsou mnohem silnější ve srovnání s vodíkovými vazbami. |
| Vznikl mezi | Mezi dvěma atomy dvou různých molekul vzniká vodíková vazba. | Vzniká mezi dvěma atomy. |
| Příklady | Kyselina salicylová, voda, glukóza atd. | Metan, oxid uhelnatý atd. |
Co je vodíková vazba?
Vodíková vazba je elektrická přitažlivá síla mezi dvěma atomy. Vzniká, když se atom vodíku kovalentně váže s jiným elektronegativnějším bitem, jako je oktet nebo skupina.
Většinou jsou elektronegativní molekuly buď kyslík, dusík nebo fluor. Ve většině případů se elektronegativnější atom s osamoceným párem elektronů nazývá akceptor.
Vodíkové vazby jsou silnou přitažlivostí mezi částečně kladnými a kladně nabitými atomy. Jsou nejsilnější ze všech známých typů vazeb. Tyto vazby se nacházejí v mnoha kovalentní sloučeniny ale jsou slabší než kovalentní.
Elektronegativní povaha atomu vodíku spojuje dvě molekuly dohromady. Voda se tedy může pohybovat mezi částicemi a vytvářet stabilní chemické sloučeniny. Například když se mokré listy papíru slepí.
Vodíkové vazby se vyskytují mezi dvěma molekulami obsahujícími stejný typ vodíku.
Vazby CH se tvoří, když se stanou dva atomy uhlíku elektronegativita vázaný.
Ve vazbě donor/akceptor je donor protonu elektronegativní atom a akceptor protonu je ten, který není kovalentně vázán s vodíkem. Atomy vodíku v páru bází jsou drženy pohromadě vodíkovými vazbami.
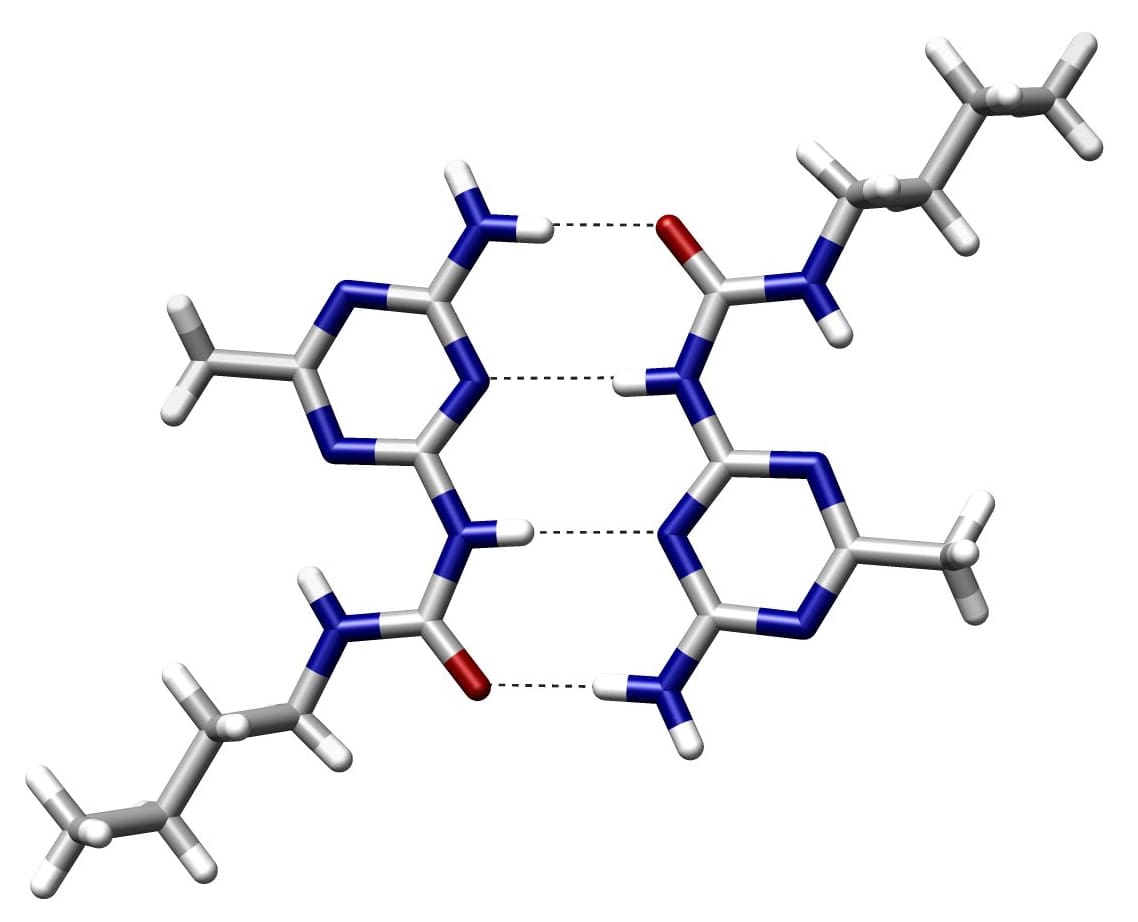
Co je to kovalentní vazba?
Dva atomy sdílejí elektronové páry za vzniku kovalentní vazby. Tyto elektronové páry se nazývají vazebné páry. Kovalentní vazby jsou vytvářeny prostřednictvím rovnováhy přitažlivých a odpudivých sil.
Zde jsou nějaké příklady. Pro ilustraci zde uvádíme chemickou rovnici. Čtěte dále a objevte vědu, která se za nimi skrývá. Nejjednodušším příkladem kovalentní vazby je sdílení páru elektronů.
Proces vazby zahrnuje sdílení elektronů mezi dvěma různými atomy. Protože elektrony sdílejí energii, mohou mít nižší energii než ostatní atomy. Zapletou se, když se centra navzájem přitahují.
„Sdílené elektrony snižují energii druhého atomu. Tomu se říká „rovnováha“. Tento jev je běžný a lze jej použít ke sledování pokroku a identifikaci základních lekcí.“ Sdílené elektrony snižují energii druhého atomu. Tomu se říká „rovnováha“. Tento jev je běžný a lze jej použít ke sledování pokroku a identifikaci základních lekcí.
Proces sdílení elektronů má za následek pokles energie. Elektron, který sdílí atom s jiným elektronem, ztratí energii. V tomto stavu se tvoří kovalentní vazba.
Elektron mezi dvěma přitahujícími se centry má nižší energii než elektron mezi dvěma neutrálními. Síla jednoho atomu se v molekule zvyšuje, pokud je sdílena s bitem s vyšší energetickou hladinou.
Hlavní rozdíly mezi vodíkovou vazbou a kovalentní vazbou
- Vodíková vazba je pouze 1/10krát silnější než vazba kovalentní.
- Vodíkové vazby jsou intramolekulární a mezimolekulární vazby. Na druhé straně kovalentní vazby jsou mezimolekulární chemické vazby.
- Vodíkové vazby se tvoří mezi dvěma atomy dvou různých molekul. Mezi dvěma atomy se tvoří kovalentní vazby.
- Vodíkové vazby jsou přitažlivé síly. Kovalentní vazby jsou chemické vazby.
- Vodíkové vazby mají nízkou stabilitu ve srovnání s kovalentními vazbami.
- https://scripts.iucr.org/cgi-bin/paper?a12816
- https://pubs.acs.org/doi/pdf/10.1021/ja01130a013
- https://aip.scitation.org/doi/abs/10.1063/1.3159673
Poslední aktualizace: 29. června 2023

Piyush Yadav strávil posledních 25 let prací jako fyzik v místní komunitě. Je to fyzik, který je zapálený pro zpřístupnění vědy našim čtenářům. Je držitelem titulu BSc v přírodních vědách a postgraduálního diplomu v oboru environmentální vědy. Více si o něm můžete přečíst na jeho bio stránka.


Vědecké vysvětlení je jasné a přesné. To mi pomohlo lépe porozumět konceptu.
Porovnání vodíkových a kovalentních vazeb je dobře vysvětleno. Skvělý článek!
Ano, naprosto souhlasím. Je to přínosné pro studenty a ostatní, kteří se zajímají o chemii.
Tento článek poskytuje hloubkovou analýzu rozdílů mezi vodíkovými a kovalentními vazbami.
Autor odvedl skvělou práci při vysvětlení pojmů na příslušných příkladech. Je to chvályhodné.
Čtení tohoto článku bylo opravdu obohacující. Ze zde uvedeného srovnání jsem získal cenné poznatky a poznatky.
Čekal jsem trochu více vědeckých důkazů na podporu některých zmíněných bodů. Dobré, ale ne skvělé.