In chimica, diversi composti sono formati da diversi tipi di legami tra le molecole.
Vari fattori determinano quale tipo di legame dovrebbe formarsi tra diverse molecole e il tipo di molecole gioca un ruolo enorme nella formazione di tali legami.
Un legame è una forza attrattiva che agisce tra due molecole.
Punti chiave
- I legami ionici si formano tra metalli e non metalli attraverso il trasferimento di elettroni, mentre i legami covalenti si formano tra non metalli attraverso la condivisione di elettroni.
- I composti ionici hanno punti di fusione e di ebollizione elevati, mentre i composti covalenti hanno punti di fusione e di ebollizione inferiori.
- I composti ionici conducono elettricità quando sono disciolti in acqua o sciolti, ma i composti covalenti no.
Legami ionici vs legame covalente
I legami ionici si formano tra gli atomi attraverso il trasferimento di elettroni, creando ioni che sono attratti l'uno dall'altro a causa delle loro cariche opposte. I legami covalenti implicano la condivisione di elettroni tra gli atomi, creando un'attrazione reciproca che tiene insieme gli atomi.
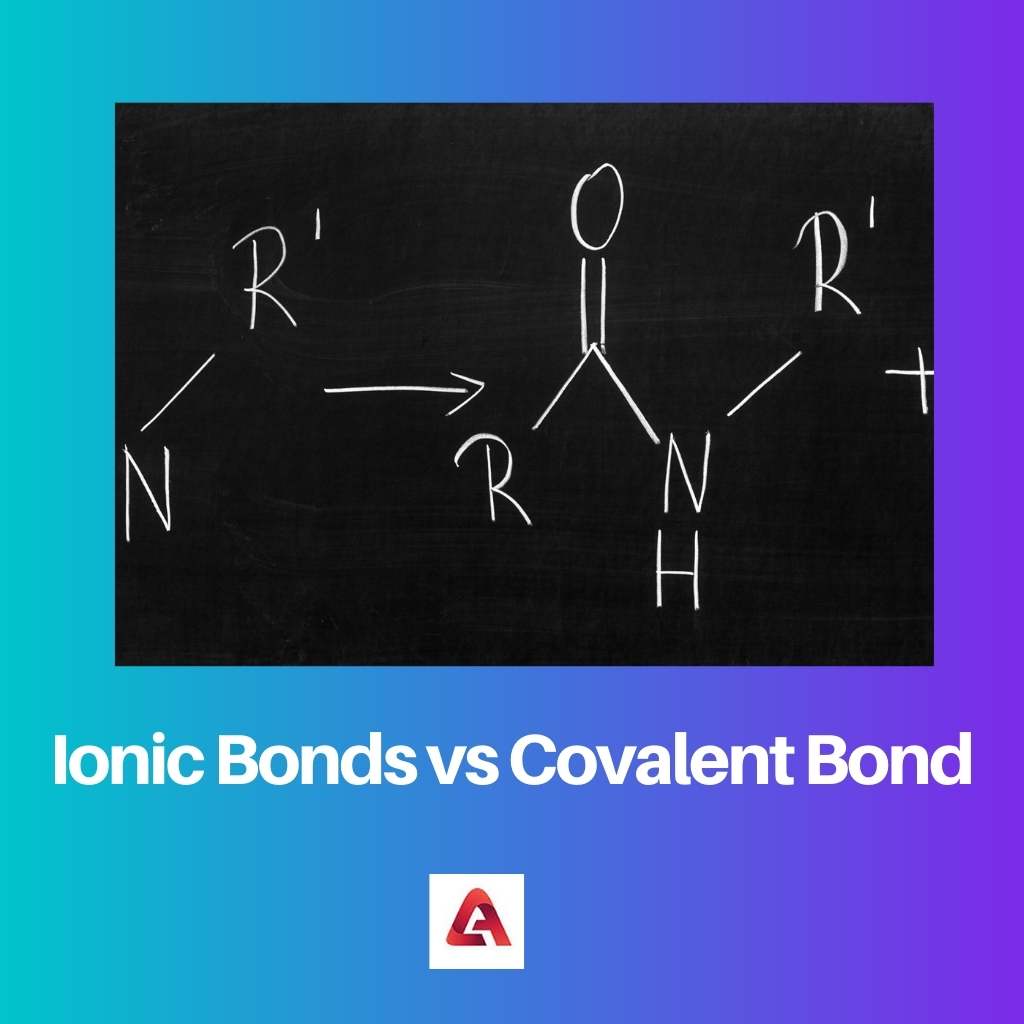
Un legame ionico si forma nel caso di composti ionici. I composti ionici sono costituiti da molecole contenenti ioni carichi, che possono essere caricati positivamente o negativamente.
Quindi questo crea una forza di attrazione tra le molecole poiché cariche opposte si attraggono a vicenda. Questa forza di attrazione si traduce nella formazione del legame.
I legami covalenti si formano tra non metalli. Questo tipo di legame si forma a causa della condivisione di elettroni tra due molecole.
Poiché una delle molecole in un composto covalente è carente di elettroni, riceve il numero richiesto di elettroni dalle molecole donatrici per creare un composto covalente stabile.
Tavola di comparazione
| Parametri di confronto | Legame ionico | Legame covalente |
|---|---|---|
| coerenti | I legami ionici si formano a causa del trasferimento di ioni tra le molecole | I legami covalenti si formano a causa della condivisione di elettroni tra due molecole |
| Stato di composto | I composti formati sono presenti solo allo stato solido | I composti formati sono presenti in tutti gli stati della materia |
| Tipo di molecole | Il legame avviene tra un metallo e un non metallo | Il legame avviene tra due non metalli |
| Polarità | I composti ionici sono apolari | I composti covalenti sono polari |
| punto di fusione | I composti ionici hanno punti di fusione più elevati | I composti covalenti hanno punti di fusione più bassi |
Cos'è il legame ionico?
Un legame ionico è uno dei tre tipi di legami che si verificano tra le molecole, formando un composto ionico.
Il legame si verifica tra un metallo e un non metallo, e uno degli esempi più comuni di tale composto è il sale (NaCl), in cui il sodio (Na) è un metallo e il cloro (Cl) è un non metallo.
È un legame forte e non può essere spezzato così facilmente come nel caso dei legami covalenti. Il legame si verifica a causa di una condivisione di elettroni tra il metallo e il non metallo.
Una delle molecole in un composto ionico è carente di elettroni, mentre l'altra molecola è ricca di elettroni, creando una forza di attrazione tra le due molecole.
La forza di attrazione elettrostatica provoca l'interazione tra le due molecole, condividendo gli elettroni dall'atomo ricco di elettroni all'atomo carente di elettroni.
L'atomo o la molecola del donatore trasferisce completamente l'atomo alla molecola o all'atomo ricevente, determinando un legame forte e pulito tra le due molecole.
Le caratteristiche di tali composti ionici sono i loro punti di fusione elevati e l'elevata conduttività elettrica allo stato fuso o disciolto. I composti ionici sono anche altamente solubili in acqua.

Cos'è il legame covalente?
Un legame covalente è un tipo di legame chimico tra molecole che porta alla formazione di un composto covalente.
È il più debole dei tre tipi di legami chimici e le molecole in un composto covalente possono essere facilmente separate.
I legami covalenti si formano tra due non metalli e il legame dei metalli delle molecole dipende dal numero di elettroni del guscio di valenza.
Il legame avviene per condivisione di coppie di elettroni e questa condivisione di elettroni avviene per mantenere l'equilibrio chimico tra le molecole o gli atomi.
La condivisione di elettroni tra due molecole instabili crea un guscio di valenza stabile in entrambe le molecole.
Quando entrambi gli atomi hanno raggiunto il loro pieno stato di valenza, si forma un legame tra i due atomi o molecole.
La coppia condivisa di elettroni è presente tra entrambi gli atomi per mantenere la stabilità del composto.
L'esempio più comune di legame covalente è tra i due atomi di idrogeno in una molecola di H2.
In una molecola di H2, i due atomi di idrogeno condividono due elettroni che portano a un legame covalente.
Il fattore chiave richiesto per la formazione di un legame covalente è l'elettronegatività delle molecole. Due atomi con elettronegatività simili danno luogo a un legame covalente.

Principali differenze tra legame ionico e covalente
- I legami ionici si formano a causa del trasferimento di ioni tra le molecole. I legami covalenti si formano a causa della condivisione di elettroni tra gli atomi.
- I composti ionici sono presenti solo allo stato solido. Composti covalenti sono presenti in tutti gli stati della materia.
- Si forma un legame ionico tra un metallo e un non metallo. Un legame covalente si forma tra due non metalli.
- I composti ionici sono apolari, mentre i composti covalenti sono polari
- I composti ionici hanno punti di fusione molto elevati, mentre i composti covalenti hanno punti di fusione bassi.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Ultimo aggiornamento: 14 giugno 2023

Piyush Yadav ha trascorso gli ultimi 25 anni lavorando come fisico nella comunità locale. È un fisico appassionato di rendere la scienza più accessibile ai nostri lettori. Ha conseguito una laurea in scienze naturali e un diploma post-laurea in scienze ambientali. Puoi leggere di più su di lui sul suo pagina bio.


Informazioni affascinanti sui legami ionici e covalenti, la quantità di informazioni dettagliate nell'articolo è notevole e molto facile da capire
Articolo interessante. Apprezzo la discussione approfondita sulle caratteristiche dei composti ionici e covalenti.
Non sono d'accordo. I legami covalenti non sono necessariamente i più deboli dei tre tipi di legami chimici. Ci sono casi in cui sono più forti dei legami ionici.
Questo è vero in determinate circostanze, ma in generale l'affermazione vale. I legami covalenti sono considerati più deboli a causa della facilità con cui si spezzano.
Ottima spiegazione sui legami ionici e covalenti. Non vedo l'ora di leggere altro da questo autore.
Sì, il post era molto informativo e facile da capire. Apprezzo la tabella comparativa per riassumere le differenze tra le due tipologie di obbligazioni.
Questo articolo semplifica l'argomento ma sembra esserci una grave mancanza di riferimento ai dati. Maggiore credibilità può essere data con citazioni adeguate
Sono d'accordo. Ho controllato i riferimenti forniti e sono fonti credibili.
Ho trovato le informazioni molto utili, soprattutto per il mio prossimo esame di chimica
L'autore sembra essere molto esperto quando si tratta di chimica. Mi piace leggere post dettagliati come questo.
Concordato. La tabella comparativa è molto utile per evidenziare le distinzioni tra legami ionici e covalenti.
L'articolo spiega gli argomenti che sono molto utili per l'apprendimento introduttivo.
Questo post fornisce una panoramica completa dei legami ionici e covalenti. Gli esempi sono molto utili per comprendere i concetti.
Informazioni adeguate e utili per scopi didattici. Una lettura obbligata per gli studenti delle scuole superiori
La tabella comparativa è un ottimo modo per illustrare le differenze, per chiunque abbia una conoscenza di base di chimica questo articolo potrebbe essere una risorsa meravigliosa
Sono d'accordo. Anche i concetti chiave sono molto utili e semplificano i concetti.
L'articolo presenta chiaramente le differenze tra legami ionici e covalenti. L'ho trovato molto utile.