Ķīmijā dažādus savienojumus veido dažāda veida saites starp molekulām.
Dažādi faktori nosaka, kāda veida saite jāveido starp dažādām molekulām, un molekulu veidam ir milzīga loma šādu saišu veidošanā.
Saite ir pievilcīgs spēks, kas darbojas starp divām molekulām.
Atslēgas
- Jonu saites veidojas starp metāliem un nemetāliem, pārnesot elektronus, savukārt kovalentās saites veidojas starp nemetāliem, daloties elektroniem.
- Jonu savienojumiem ir augsta kušanas un viršanas temperatūra, savukārt kovalentajiem savienojumiem ir zemāka kušanas un viršanas temperatūra.
- Jonu savienojumi vada elektrību, kad tie ir izšķīdināti ūdenī vai izkausēti, bet kovalentie savienojumi to nedara.
Jonu saites pret kovalento saiti
Jonu saites starp atomiem veidojas elektronu pārneses ceļā, veidojot jonus, kas tiek piesaistīti viens otram to pretējo lādiņu dēļ. Kovalentās saites ietver elektronu koplietošanu starp atomiem, radot savstarpēju pievilcību, kas satur atomus kopā.
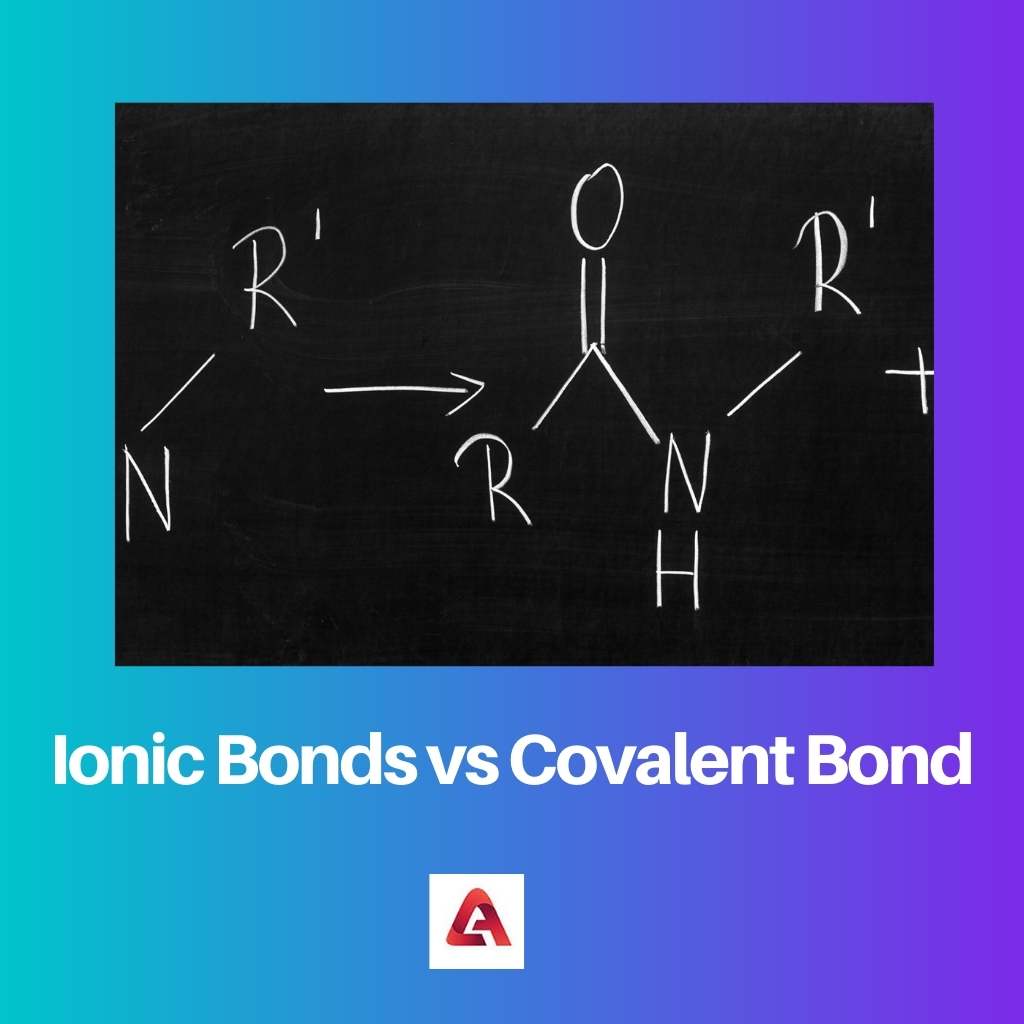
Jonu savienojumu gadījumā veidojas jonu saite. Jonu savienojumi ir izgatavoti no molekulām, kas satur lādētus jonus, kas var būt pozitīvi vai negatīvi lādēti.
Tādējādi tas rada pievilkšanās spēku starp molekulām, jo pretējie lādiņi piesaista viens otru. Šī pievilkšanās spēka rezultātā veidojas saite.
Starp nemetāliem veidojas kovalentās saites. Šāda veida saites veidojas elektronu dalīšanas dēļ starp divām molekulām.
Tā kā vienai no kovalentā savienojuma molekulām ir elektronu deficīts, tā saņem nepieciešamo elektronu skaitu no donormolekulām, lai izveidotu stabilu kovalento savienojumu.
Salīdzināšanas tabula
| Salīdzināšanas parametri | Jonu Bonds | Kovalentā obligācija |
|---|---|---|
| Radīšana | Jonu saites veidojas jonu pārneses dēļ starp molekulām | Kovalentās saites veidojas, daloties elektroniem starp divām molekulām |
| Savienojuma stāvoklis | Izveidotie savienojumi ir tikai cietā stāvoklī | Izveidotie savienojumi atrodas visos vielas stāvokļos |
| Molekulu veids | Savienojums notiek starp metālu un nemetālu | Savienojums notiek starp diviem nemetāliem |
| Polaritāte | Jonu savienojumi ir nepolāri | Kovalentie savienojumi ir polāri |
| Kušanas punkts | Jonu savienojumiem ir augstāks kušanas punkts | Kovalentajiem savienojumiem ir zemāki kušanas punkti |
Kas ir jonu saite?
Jonu saite ir viens no trim saišu veidiem, kas rodas starp molekulām, veidojot jonu savienojumu.
Saite rodas starp metālu un nemetālu, un viens no visbiežāk sastopamajiem šāda savienojuma piemēriem ir sāls (NaCl), kurā nātrijs (Na) ir metāls un hlors (Cl) ir nemetāls.
Tā ir spēcīga saite, un to nevar saraut tik viegli kā kovalento saišu gadījumā. Saite rodas elektronu dalīšanas dēļ starp metālu un nemetālu.
Vienai no jonu savienojuma molekulām ir elektronu deficīts, bet otra molekula ir bagāta ar elektroniem, radot pievilkšanās spēku starp abām molekulām.
Elektrostatiskais pievilkšanas spēks izraisa mijiedarbību starp abām molekulām, dalot elektronus no elektroniem bagātā atoma uz elektronu deficīta atomu.
Donora atoms vai molekula pilnībā nodod atomu uztvērēja molekulai vai atomam, kā rezultātā starp abām molekulām veidojas spēcīga un tīra saite.
Šādu jonu savienojumu īpašības ir to augstie kušanas punkti un augstā elektrovadītspēja izkausētā vai izšķīdinātā stāvoklī. Jonu savienojumi arī labi šķīst ūdenī.

Kas ir kovalentā saite?
Kovalentā saite ir ķīmiskās saites veids starp molekulām, kas noved pie kovalenta savienojuma veidošanās.
Tā ir vājākā no trim ķīmisko saišu veidiem, un kovalentā savienojuma molekulas var viegli atdalīt.
Starp diviem nemetāliem veidojas kovalentās saites, un molekulu metālu saite ir atkarīga no valences apvalka elektronu skaita.
Saistīšana notiek, daloties elektronu pāriem, un šī elektronu koplietošana notiek, lai uzturētu ķīmisko līdzsvaru starp molekulām vai atomiem.
Elektronu dalīšana starp divām nestabilām molekulām rada stabilu valences apvalku abās molekulās.
Kad abi atomi ir sasnieguši pilnu valences stāvokli, starp diviem atomiem vai molekulām veidojas saite.
Kopīgais elektronu pāris atrodas starp abiem atomiem, lai saglabātu savienojuma stabilitāti.
Visizplatītākais kovalentās saites piemērs ir starp diviem ūdeņraža atomiem H2 molekulā.
H2 molekulā diviem ūdeņraža atomiem ir kopīgi divi elektroni, kas noved pie kovalentās saites.
Galvenais faktors, kas nepieciešams kovalentās saites veidošanai, ir molekulu elektronegativitāte. Divi atomi ar līdzīgu elektronegativitāti rada kovalento saiti.

Galvenās atšķirības starp jonu un kovalento saiti
- Jonu saites veidojas jonu pārneses dēļ starp molekulām. Kovalentās saites veidojas, daloties elektroniem starp atomiem.
- Jonu savienojumi ir tikai cietā stāvoklī. Kovalenti savienojumi atrodas visos matērijas stāvokļos.
- Starp metālu un nemetālu veidojas jonu saite. Starp diviem nemetāliem veidojas kovalentā saite.
- Jonu savienojumi ir nepolāri, savukārt kovalentie savienojumi ir polāri
- Jonu savienojumiem ir ļoti augsts kušanas punkts, savukārt kovalentajiem savienojumiem ir zems kušanas punkts.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Pēdējo reizi atjaunināts: 14. gada 2023. jūnijā

Pijušs Jadavs pēdējos 25 gadus ir pavadījis, strādājot par fiziķi vietējā sabiedrībā. Viņš ir fiziķis, kurš aizrautīgi cenšas padarīt zinātni pieejamāku mūsu lasītājiem. Viņam ir bakalaura grāds dabaszinātnēs un pēcdiploma diploms vides zinātnē. Vairāk par viņu varat lasīt viņa vietnē bio lapa.


Aizraujoša informācija par jonu un kovalentajām saitēm, rakstā sniegtās informācijas apjoms ir ievērojams un ļoti viegli saprotams
Interesants raksts. Es novērtēju padziļināto diskusiju par jonu un kovalento savienojumu īpašībām.
ES nepiekrītu. Kovalentās saites ne vienmēr ir vājākās no trim ķīmisko saišu veidiem. Ir gadījumi, kad tie ir stiprāki par jonu saitēm.
Tas ir taisnība noteiktos apstākļos, bet kopumā apgalvojums ir spēkā. Kovalentās saites tiek uzskatītas par vājākajām, jo saiti ir viegli saraut.
Lielisks skaidrojums par jonu un kovalentajām saitēm. Es ceru lasīt vairāk no šī autora.
Jā, ieraksts bija ļoti informatīvs un viegli saprotams. Es novērtēju salīdzināšanas tabulu, lai apkopotu atšķirības starp diviem obligāciju veidiem.
Šis raksts vienkāršo tēmu, taču šķiet, ka trūkst datu atsauces. Lielāku uzticamību var nodrošināt ar pareiziem citātiem
ES piekrītu. Es pārbaudīju sniegtās atsauces, un tās ir ticami avoti.
Man šī informācija šķita ļoti noderīga, īpaši manam gaidāmajam ķīmijas eksāmenam
Šķiet, ka autors ir ļoti zinošs ķīmijā. Man patīk lasīt detalizētas ziņas, piemēram, šo.
Piekritu. Salīdzināšanas tabula ir ļoti noderīga, lai izceltu atšķirības starp jonu un kovalentajām saitēm.
Rakstā ir izskaidrotas tēmas, kas ir ļoti noderīgas ievadmācībām.
Šī ziņa sniedz visaptverošu pārskatu par jonu un kovalentajām saitēm. Piemēri ļoti palīdz izprast jēdzienus.
Adekvāta informācija, kas ir vērtīga izglītības nolūkos. Obligāta literatūra vidusskolēniem
Salīdzināšanas tabula ir lielisks veids, kā ilustrēt atšķirības, jo ikvienam, kam ir pamata zināšanas ķīmijā, šis raksts varētu būt lielisks resurss.
ES piekrītu. Arī galvenie ieteikumi ir diezgan noderīgi un vienkāršo jēdzienus.
Rakstā ir skaidri parādītas atšķirības starp jonu un kovalentajām saitēm. Man tas šķita ļoti noderīgi.