Starp kovalento un ogļūdeņraža saiti ir daudz būtisku atšķirību. Ķīmija, vielu – elementu un savienojumu izpēte, sākas ar divu atomu un molekulu saišu pamatiem.
Šajā rakstā tiks izskaidrotas atšķirības starp ūdeņraža un kovalentajām saitēm un to veidošanās veidu. Apskatīsim divu veidu ķīmiskās saites. Mijiedarbības veids padara kovalento molekulu atšķirīgu no ogļūdeņraža molekulas.
Atslēgas
- Ūdeņraža saites veidojas starp molekulām, kad ūdeņraža atoms saistās ar ļoti elektronnegatīvu atomu; kovalentās saites dala elektronus starp atomiem molekulā.
- Ūdeņraža saites ir vājākas nekā kovalentās saites, nodrošinot īslaicīgu un atgriezenisku mijiedarbību.
- Ūdeņraža saites veicina bioloģisko molekulu struktūru un funkcijas; kovalentās saites veido molekulāro struktūru pamatu.
Ūdeņraža saite pret kovalento saiti
Ūdeņraža saites rodas, kad pozitīvi lādēts ūdeņraža atoms mijiedarbojas ar elektronnegatīvu atomu, radot salīdzinoši vājāku saiti nekā kovalentās saites, kas ietver elektronu koplietošanu. Šīs saites ir būtiskas ūdens unikālajām īpašībām. Kovalentās saites veido pamatu lielākajai daļai molekulu.

Ūdeņraža saite var būt intramolekulāra vai starpmolekulāra. Ar ūdeņraža saiti saistītā enerģija mainās atkarībā no ģeometrijas un atomu vides.
Tā ir vājāka saite nekā van der Vālsa mijiedarbība, kas notiek organiskās un neorganiskās molekulās. Daži ūdeņraža saišu piemēri ir salicilskābe, H2O (ūdens), metilspirts, cukurs utt.
Kovalentās saites ir starpmolekulāro spēku formas. Tie veidojas, kad divi vai vairāki atomi dalās ar elektroniem, lai aizpildītu attālākos elektronu apvalkus. Kovalentās saites ir daudz spēcīgākas nekā ūdeņraža saites, un tām ir augsta stabilitāte.
Salīdzināšanas tabula
| Salīdzināšanas parametri | Ūdeņraža saite | Kovalentā obligācija |
|---|---|---|
| Kas viņi ir? | Ūdeņraža saite ir pievilkšanās spēks starp ūdeņraža atomu un elektronnegatīvāku atomu. | Kovalentās saites ir ķīmiskas saites, kas veidojas, daloties elektroniem. |
| Spēki | Starpmolekulārie un intramolekulārie spēki. | Starpmolekulārie spēki. |
| spēks | Tas veidojas starp diviem atomiem. | Kovalentās saites ir daudz spēcīgākas nekā ūdeņraža saites. |
| Veidojas starp | Ūdeņraža saite veidojas starp diviem dažādu molekulu atomiem. | Veidojas starp diviem atomiem. |
| Piemēri | Salicilskābe, ūdens, glikoze utt. | Metāns, oglekļa monoksīds utt. |
Kas ir ūdeņraža saite?
Ūdeņraža saite ir elektrisks pievilkšanās spēks starp diviem atomiem. Tas tiek izveidots, kad ūdeņraža atoms kovalenti saistās ar citu elektronnegatīvāku bitu, piemēram, oktetu vai grupu.
Pārsvarā elektronnegatīvās molekulas ir skābeklis, slāpeklis vai fluors. Vairumā gadījumu elektronnegatīvāku atomu ar vientuļo elektronu pāri sauc par akceptoru.
Ūdeņraža saites ir spēcīgas pievilcības starp daļēji pozitīviem un pozitīvi lādētiem atomiem. Tās ir spēcīgākās no visiem zināmajiem obligāciju veidiem. Šīs saites ir atrodamas daudzās kovalenti savienojumi bet ir vājāki par kovalentajiem.
Ūdeņraža atoma elektronnegatīvā daba saista abas molekulas kopā. Tāpēc ūdens var pārvietoties starp daļiņām un veidot stabilus ķīmiskos savienojumus. Piemēram, kad slapjas papīra loksnes salīp kopā.
Ūdeņraža saites rodas starp divām molekulām, kas satur viena veida ūdeņradi.
CH saites veidojas, kad kļūst divi oglekļa atomi elektronegativitāte saistīts.
Donora/akceptora saitē protonu donors ir elektronnegatīvs atoms, un protonu akceptors ir tas, kas nav kovalenti saistīts ar ūdeņradi. Ūdeņraža atomi bāzes pārī tiek turēti kopā ar ūdeņraža saiti.
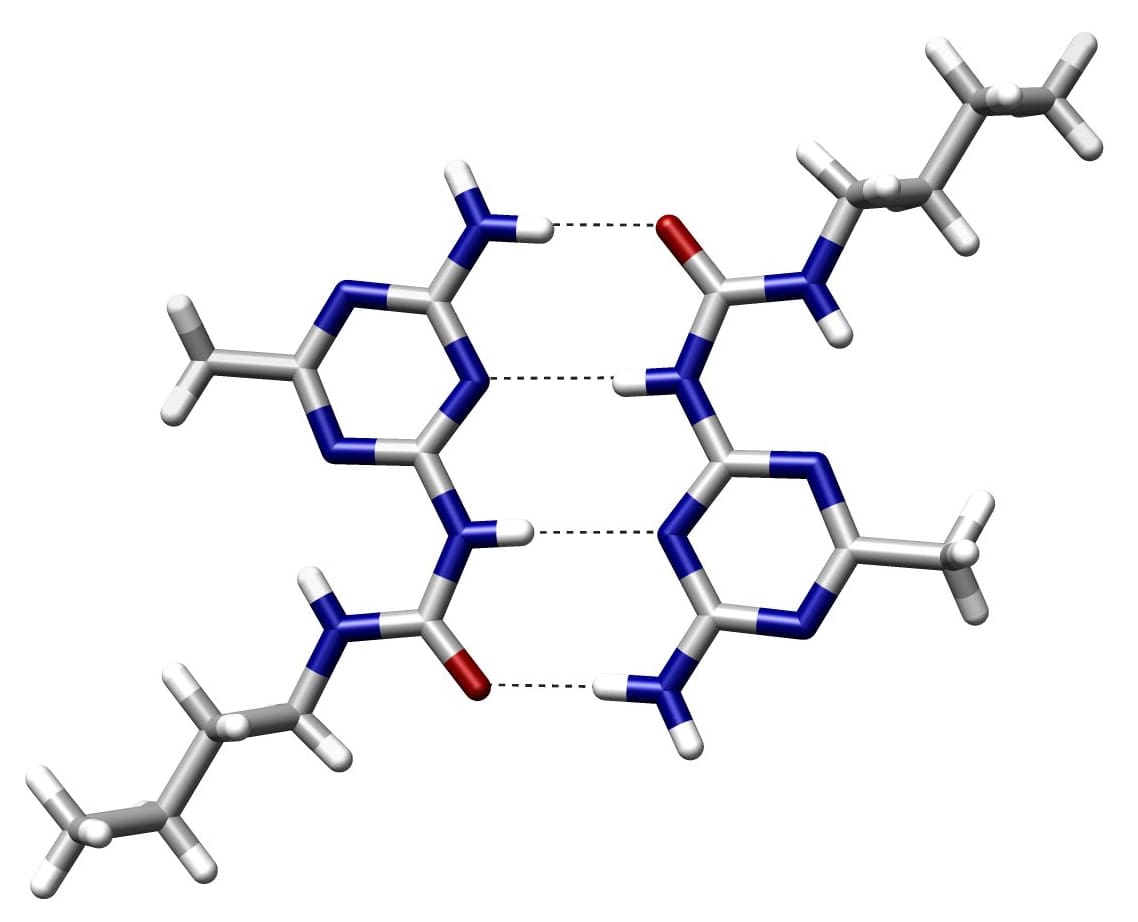
Kas ir kovalentā saite?
Diviem atomiem ir kopīgi elektronu pāri, veidojot kovalento saiti. Šos elektronu pārus sauc par savienojošajiem pāriem. Kovalentās saites tiek izveidotas, līdzsvarojot pievilcīgus un atgrūdošus spēkus.
Šeit ir daži piemēri. Lai ilustrētu, šeit ir ķīmiskais vienādojums. Lasiet tālāk, lai atklātu to zinātni. Vienkāršākais kovalentās saites piemērs ir elektronu pāra koplietošana.
Saistīšanas process ietver elektronu koplietošanu starp diviem dažādiem atomiem. Tā kā elektroniem ir kopīga enerģija, tiem var būt mazāka enerģija nekā citiem atomiem. Tie sapinās, kad centri piesaista viens otru.
"Kopīgie elektroni samazina otra atoma enerģiju. To sauc par "līdzsvaru". Šī parādība ir izplatīta, un to var izmantot, lai izsekotu progresam un noteiktu būtiskas mācības.” Kopīgie elektroni samazina otra atoma enerģiju. To sauc par "līdzsvaru". Šī parādība ir izplatīta, un to var izmantot, lai izsekotu progresam un noteiktu būtiskas mācības.
Elektronu dalīšanas process izraisa enerģijas samazināšanos. Elektrons, kuram ir kopīgs atoms ar citu elektronu, zaudēs jaudu. Šajā stāvoklī veidojas kovalentā saite.
Elektronam starp diviem piesaistes centriem ir mazāka enerģija nekā elektronam starp diviem neitrāliem centriem. Atsevišķa atoma jauda molekulā palielinās, ja to dala ar bitu ar augstāku enerģijas līmeni.
Galvenās atšķirības starp ūdeņraža saiti un kovalento saiti
- Ūdeņraža saite ir tikai 1/10 reizes spēcīgāka par kovalento saiti.
- Ūdeņraža saites ir intramolekulāras un starpmolekulāras saites. No otras puses, kovalentās saites ir starpmolekulārās ķīmiskās saites.
- Ūdeņraža saites veidojas starp diviem dažādu molekulu atomiem. Starp diviem atomiem veidojas kovalentās saites.
- Ūdeņraža saites ir pievilkšanas spēki. Kovalentās saites ir ķīmiskās saites.
- Ūdeņraža saitēm ir zema stabilitāte, salīdzinot ar kovalentajām saitēm.
- https://scripts.iucr.org/cgi-bin/paper?a12816
- https://pubs.acs.org/doi/pdf/10.1021/ja01130a013
- https://aip.scitation.org/doi/abs/10.1063/1.3159673
Pēdējo reizi atjaunināts: 29. gada 2023. jūnijā

Pijušs Jadavs pēdējos 25 gadus ir pavadījis, strādājot par fiziķi vietējā sabiedrībā. Viņš ir fiziķis, kurš aizrautīgi cenšas padarīt zinātni pieejamāku mūsu lasītājiem. Viņam ir bakalaura grāds dabaszinātnēs un pēcdiploma diploms vides zinātnē. Vairāk par viņu varat lasīt viņa vietnē bio lapa.


Zinātniskais skaidrojums ir skaidrs un precīzs. Tas man ir palīdzējis labāk izprast šo jēdzienu.
Ūdeņraža un kovalento saišu salīdzinājums ir labi izskaidrots. Lielisks raksts!
Jā, pilnībā piekrītu. Tas ir izdevīgi studentiem un citiem, kas interesējas par ķīmiju.
Šajā rakstā ir sniegta padziļināta analīze par atšķirībām starp ūdeņraža un kovalentajām saitēm.
Autors ir paveicis izcilu darbu, skaidrojot jēdzienus ar atbilstošiem piemēriem. Tas ir apsveicami.
Šī raksta lasīšana bija patiesi bagātinoša. No šeit sniegtā salīdzinājuma esmu guvis vērtīgas atziņas un zināšanas.
Es gaidīju nedaudz vairāk zinātnisku pierādījumu, lai atbalstītu dažus no minētajiem punktiem. Labi, bet ne lieliski.