Er zijn veel kritische verschillen tussen een covalente en een koolwaterstofbinding. Chemie, de studie van stoffen - elementen en verbindingen, begint met de basis van bindingen tussen twee atomen en moleculen.
Dit artikel legt de verschillen uit tussen waterstof en covalente bindingen en hoe ze worden gevormd. We zullen kijken naar de twee soorten chemische bindingen. Het interactietype maakt een covalent molecuul anders dan een koolwaterstofmolecuul.
Key Takeaways
- Waterstofbruggen vormen zich tussen moleculen wanneer een waterstofatoom zich bindt aan een sterk elektronegatief atoom; covalente bindingen delen elektronen tussen atomen binnen een molecuul.
- Waterstofbindingen zijn zwakker dan covalente bindingen en bieden tijdelijke en omkeerbare interacties.
- Waterstofbruggen dragen bij aan de structuur en functie van biologische moleculen; covalente bindingen vormen de basis van moleculaire structuren.
Waterstofbinding versus covalente binding
Waterstofbindingen ontstaan wanneer een positief geladen waterstofatoom interageert met een elektronegatief atoom, waardoor een relatief zwakkere binding ontstaat dan covalente bindingen waarbij elektronen worden gedeeld. Deze bindingen zijn essentieel voor de unieke eigenschappen van water. Covalente bindingen vormen de basis van de meeste moleculen.

Een waterstofbinding kan intramoleculair of intermoleculair zijn. De energie geassocieerd met een waterstofbinding varieert afhankelijk van de geometrie en de omgeving van de atomen.
Het is een zwakkere binding dan de van der Waals-interactie, die voorkomt in organische en anorganische moleculen. Enkele voorbeelden van waterstofbruggen zijn salicylzuur, H2O (water), methylalcohol, suiker, enz.
Covalente bindingen zijn vormen van intermoleculaire krachten. Ze worden gevormd wanneer twee of meer atomen hun elektronen delen om hun buitenste elektronenschillen te vullen. Covalente bindingen zijn veel sterker dan waterstofbruggen en hebben een hoge stabiliteit.
Vergelijkingstabel
| Parameters van vergelijking: | Waterstofbinding | Covalente binding |
|---|---|---|
| Wat zijn ze? | Een waterstofbrug is een aantrekkingskracht tussen een waterstofatoom en een meer elektronegatief atoom. | Covalente bindingen zijn chemische bindingen die worden gevormd door het delen van elektronen. |
| Krachten | Intermoleculaire en intramoleculaire krachten. | Intermoleculaire krachten. |
| Sterkte | Het wordt gevormd tussen twee atomen. | Covalente bindingen zijn veel sterker in vergelijking met waterstofbruggen. |
| Gevormd tussen | Een waterstofbrug wordt gevormd tussen twee atomen van twee verschillende moleculen. | Gevormd tussen twee atomen. |
| Voorbeelden | Salicylzuur, Water, Glucose, enz. | Methaan, koolmonoxide, enz. |
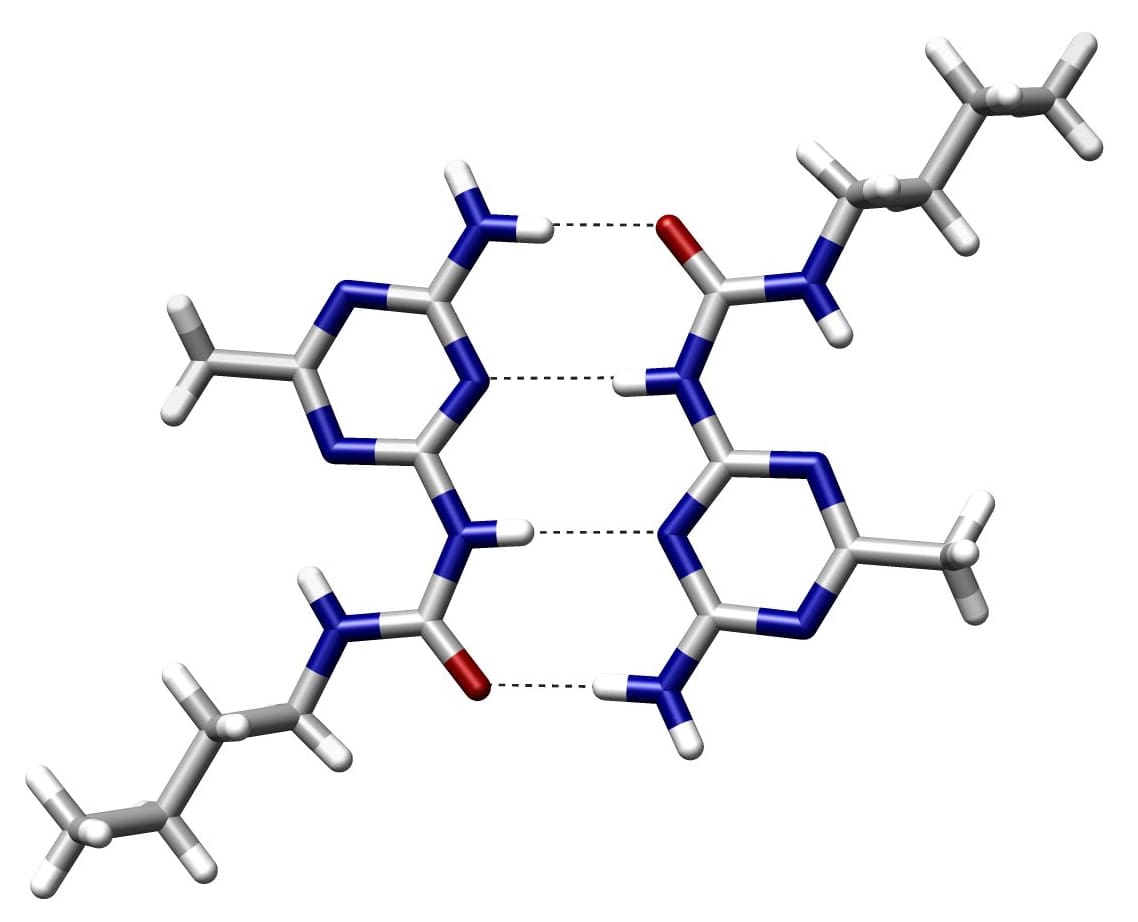
Wat is een waterstofbrug?
Een waterstofbrug is een elektrische aantrekkingskracht tussen twee atomen. Het ontstaat wanneer een waterstofatoom zich covalent bindt met een ander, meer elektronegatief bit, zoals een octet of een groep.
Meestal zijn de elektronegatieve moleculen zuurstof, stikstof of fluor. In de meeste gevallen wordt een meer elektronegatief atoom met een eenzaam paar elektronen de acceptor genoemd.
Waterstofbruggen zijn sterke aantrekkingen tussen gedeeltelijk positief en positief geladen atomen. Ze zijn de sterkste van alle bekende soorten obligaties. Deze obligaties zijn in velen te vinden covalente verbindingen maar zijn zwakker dan de covalente.
De elektronegatieve aard van het waterstofatoom verbindt de twee moleculen met elkaar. Water kan daardoor tussen de deeltjes bewegen en stabiele chemische verbindingen vormen. Bijvoorbeeld wanneer natte vellen papier aan elkaar plakken.
Waterstofbruggen komen voor tussen twee moleculen die hetzelfde type waterstof bevatten.
CH-bindingen worden gevormd wanneer twee koolstofatomen worden elektronegativiteit gebonden.
In een donor/acceptorbinding is de protondonor het elektronegatieve atoom en de protonacceptor is degene die niet covalent gebonden is met waterstof. De waterstofatomen in het basenpaar worden bij elkaar gehouden door waterstofbruggen.
Wat is een covalente binding?
Twee atomen delen elektronenparen om een covalente binding te vormen. Deze elektronenparen worden bindingsparen genoemd. Covalente bindingen worden gecreëerd door een balans van aantrekkende en afstotende krachten.
Hier zijn enkele voorbeelden. Ter illustratie volgt hier een chemische vergelijking. Lees verder om de wetenschap erachter te ontdekken. Het eenvoudigste voorbeeld van covalente binding is het delen van een paar elektronen.
Het bindingsproces omvat het delen van elektronen tussen twee verschillende atomen. Omdat elektronen energie delen, kunnen ze een lagere energie hebben dan de andere atomen. Ze raken verstrikt wanneer de centra elkaar aantrekken.
“De gedeelde elektronen verminderen de energie van het andere atoom. Dit wordt "evenwicht" genoemd. Dit fenomeen komt vaak voor en kan worden gebruikt om de voortgang bij te houden en essentiële lessen te trekken.” De gedeelde elektronen verminderen de energie van het andere atoom. Dit wordt "evenwicht" genoemd. Dit fenomeen komt veel voor en kan worden gebruikt om de voortgang bij te houden en essentiële lessen te trekken.
Het proces van het delen van elektronen resulteert in een afname van energie. Het elektron dat een atoom deelt met een ander elektron verliest kracht. Het is in deze toestand dat de covalente binding wordt gevormd.
Een elektron tussen twee aantrekkende centra heeft een lagere energie dan een elektron tussen twee neutrale centra. De kracht van een enkel atoom in een molecuul neemt toe als het wordt gedeeld met een bit met een hoger energieniveau.
Belangrijkste verschillen tussen een waterstofbinding en een covalente binding
- Een waterstofbinding is slechts 1/10 keer sterker dan een covalente binding.
- Waterstofbindingen zijn intramoleculaire en intermoleculaire bindingen. Aan de andere kant zijn covalente bindingen intermoleculaire chemische bindingen.
- Waterstofbruggen worden gevormd tussen twee atomen van twee verschillende moleculen. Covalente bindingen worden gevormd tussen twee atomen.
- Waterstofbruggen zijn aantrekkingskrachten. Covalente bindingen zijn chemische bindingen.
- Waterstofbindingen hebben een lage stabiliteit in vergelijking met covalente bindingen.
- https://scripts.iucr.org/cgi-bin/paper?a12816
- https://pubs.acs.org/doi/pdf/10.1021/ja01130a013
- https://aip.scitation.org/doi/abs/10.1063/1.3159673
Laatst bijgewerkt: 29 juni 2023

Piyush Yadav heeft de afgelopen 25 jaar als natuurkundige in de lokale gemeenschap gewerkt. Hij is een natuurkundige die gepassioneerd is om wetenschap toegankelijker te maken voor onze lezers. Hij heeft een BSc in natuurwetenschappen en een postdoctoraal diploma in milieuwetenschappen. Je kunt meer over hem lezen op zijn bio pagina.


De wetenschappelijke verklaring is duidelijk en nauwkeurig. Dit heeft mij geholpen het concept beter te begrijpen.
De vergelijking van de waterstof- en covalente bindingen wordt goed uitgelegd. Geweldig artikel!
Ja, ik ben het er volledig mee eens. Het is gunstig voor studenten en anderen die geïnteresseerd zijn in scheikunde.
Dit artikel geeft een diepgaande analyse van de verschillen tussen waterstof- en covalente bindingen.
De auteur heeft uitstekend werk verricht door de concepten uit te leggen met relevante voorbeelden. Het is prijzenswaardig.
Het lezen van dit artikel was werkelijk verrijkend. Ik heb waardevolle inzichten en kennis verkregen uit de hier gegeven vergelijking.
Ik verwachtte wat meer wetenschappelijk bewijs ter ondersteuning van enkele van de genoemde punten. Goed, maar niet geweldig.