In de chemie worden verschillende verbindingen gevormd door verschillende soorten bindingen tussen de moleculen.
Verschillende factoren bepalen welk type binding tussen verschillende moleculen moet worden gevormd, en het type moleculen speelt een grote rol bij de vorming van dergelijke bindingen.
Een binding is een aantrekkingskracht tussen twee moleculen.
Key Takeaways
- Ionische bindingen worden gevormd tussen metalen en niet-metalen door de overdracht van elektronen, terwijl covalente bindingen worden gevormd tussen niet-metalen door het delen van elektronen.
- Ionische verbindingen hebben hoge smelt- en kookpunten, terwijl covalente verbindingen lagere smelt- en kookpunten hebben.
- Ionische verbindingen geleiden elektriciteit wanneer ze in water zijn opgelost of gesmolten, maar covalente verbindingen niet.
Ionische bindingen versus covalente binding
Ionische bindingen worden gevormd tussen atomen door de overdracht van elektronen, waardoor ionen ontstaan die door hun tegengestelde ladingen tot elkaar worden aangetrokken. Covalente bindingen omvatten het delen van elektronen tussen atomen, waardoor een wederzijdse aantrekkingskracht ontstaat die de atomen bij elkaar houdt.
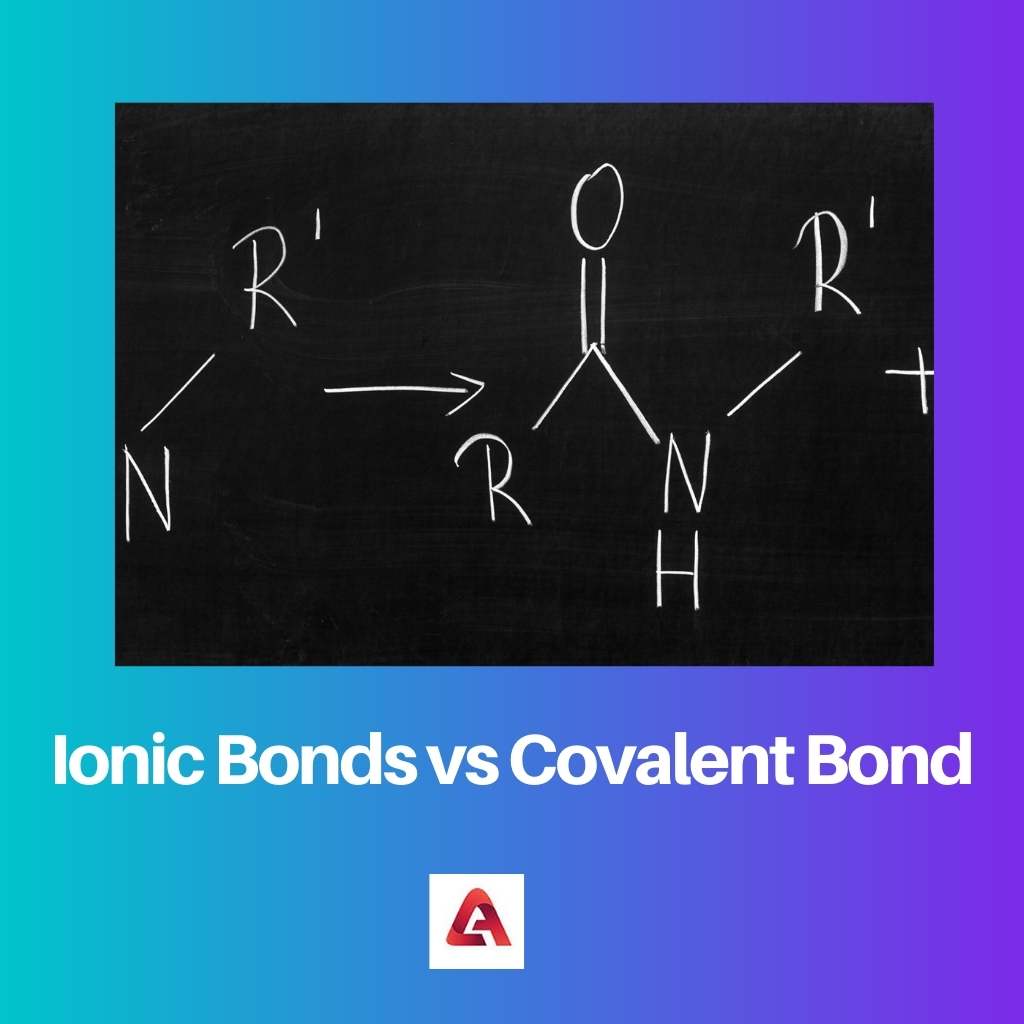
Bij ionische verbindingen wordt een ionische binding gevormd. Ionische verbindingen zijn gemaakt van moleculen die geladen ionen bevatten, die zowel positief als negatief geladen kunnen zijn.
Dit creëert dus een aantrekkingskracht tussen de moleculen omdat tegengestelde ladingen elkaar aantrekken. Deze aantrekkingskracht resulteert in de vorming van de band.
Covalente bindingen worden gevormd tussen niet-metalen. Dit type binding wordt gevormd door het delen van elektronen tussen twee moleculen.
Omdat een van de moleculen in een covalente verbinding een tekort aan elektronen heeft, ontvangt het het vereiste aantal elektronen van de donormoleculen om een stabiele covalente verbinding te creëren.
Vergelijkingstabel
| Parameters van vergelijking: | Ionbinding | Covalente binding |
|---|---|---|
| Creatie | Ionische bindingen worden gevormd door de overdracht van ionen tussen moleculen | Covalente bindingen worden gevormd door het delen van elektronen tussen twee moleculen |
| Staat van verbinding | De gevormde verbindingen zijn alleen in vaste toestand aanwezig | De gevormde verbindingen zijn aanwezig in alle toestanden van de materie |
| Soort moleculen | De binding vindt plaats tussen een metaal en een niet-metaal | De binding vindt plaats tussen twee niet-metalen |
| Polariteit | Ionische verbindingen zijn apolair | Covalente verbindingen zijn polair |
| Smeltpunt | Ionische verbindingen hebben hogere smeltpunten | Covalente verbindingen hebben lagere smeltpunten |
Wat is ionische binding?
Een ionische binding is een van de drie soorten bindingen die tussen moleculen voorkomen en een ionische verbinding vormen.
De binding vindt plaats tussen een metaal en een niet-metaal, en een van de meest voorkomende voorbeelden van een dergelijke verbinding is zout (NaCl), waarin natrium (Na) een metaal is en chloor (Cl) een niet-metaal is.
Het is een sterke binding en kan niet zo gemakkelijk worden verbroken als in het geval van covalente bindingen. De binding vindt plaats door het delen van elektronen tussen het metaal en het niet-metaal.
Een van de moleculen in een ionische verbinding heeft een tekort aan elektronen, terwijl het andere molecuul rijk is aan elektronen, waardoor er een aantrekkingskracht tussen de twee moleculen ontstaat.
De elektrostatische aantrekkingskracht resulteert in de interactie tussen de twee moleculen, waarbij elektronen worden gedeeld van het elektronenrijke atoom tot het elektron-deficiënte atoom.
Het donoratoom of -molecuul draagt het atoom volledig over aan het ontvangende molecuul of atoom, wat resulteert in een sterke en zuivere binding tussen de twee moleculen.
De kenmerken van dergelijke ionische verbindingen zijn hun hoge smeltpunten en hoge elektrische geleidbaarheid in gesmolten of opgeloste toestand. Ionische verbindingen zijn ook zeer goed oplosbaar in water.

Wat is covalente binding?
Een covalente binding is een soort chemische binding tussen moleculen die leidt tot de vorming van een covalente verbinding.
Het is de zwakste van de drie soorten chemische bindingen en de moleculen in een covalente verbinding kunnen gemakkelijk worden gescheiden.
Covalente bindingen worden gevormd tussen twee niet-metalen en de binding van metalen van moleculen hangt af van het aantal elektronen in de valentieschil.
Binding vindt plaats door het delen van elektronenparen, en dit delen van elektronen vindt plaats om de chemische balans tussen de moleculen of atomen te behouden.
Het delen van elektronen tussen twee onstabiele moleculen creëert een stabiele valentieschil in beide moleculen.
Wanneer beide atomen hun volledige valentietoestand hebben bereikt, wordt er een binding gevormd tussen de twee atomen of moleculen.
Het gedeelde paar elektronen is aanwezig tussen beide atomen om de stabiliteit van de verbinding te behouden.
Het meest voorkomende voorbeeld van een covalente binding is tussen de twee waterstofatomen in een H2-molecuul.
In een H2-molecuul delen de twee waterstofatomen twee elektronen, wat leidt tot een covalente binding.
De belangrijkste factor die nodig is voor de vorming van een covalente binding zijn de elektronegativiteiten van de moleculen. Twee atomen met vergelijkbare elektronegativiteiten resulteren in een covalente binding.

Belangrijkste verschillen tussen ionische en covalente binding
- Ionische bindingen worden gevormd door de overdracht van ionen tussen moleculen. Covalente bindingen worden gevormd door het delen van elektronen tussen atomen.
- Ionische verbindingen zijn alleen in vaste toestand aanwezig. Covalente verbindingen zijn aanwezig in alle toestanden van materie.
- Een ionische binding wordt gevormd tussen een metaal en een niet-metaal. Een covalente binding wordt gevormd tussen twee niet-metalen.
- Ionische verbindingen zijn niet-polair, terwijl covalente verbindingen polair zijn
- Ionische verbindingen hebben zeer hoge smeltpunten, terwijl covalente verbindingen lage smeltpunten hebben.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Laatst bijgewerkt: 14 juni 2023

Piyush Yadav heeft de afgelopen 25 jaar als natuurkundige in de lokale gemeenschap gewerkt. Hij is een natuurkundige die gepassioneerd is om wetenschap toegankelijker te maken voor onze lezers. Hij heeft een BSc in natuurwetenschappen en een postdoctoraal diploma in milieuwetenschappen. Je kunt meer over hem lezen op zijn bio pagina.

Fascinerende informatie over ionische en covalente bindingen, de hoeveelheid informatie die in het artikel wordt beschreven is opmerkelijk en zeer gemakkelijk te begrijpen
Interessant artikel. Ik waardeer de diepgaande discussie over de kenmerken van ionische en covalente verbindingen.
Ben ik het niet mee eens. Covalente bindingen zijn niet noodzakelijkerwijs de zwakste van de drie soorten chemische bindingen. Er zijn gevallen waarin ze sterker zijn dan ionische bindingen.
Dat is in bepaalde omstandigheden waar, maar over het algemeen geldt deze verklaring. Covalente bindingen worden als het zwakst beschouwd vanwege het gemak waarmee de binding kan worden verbroken.
Uitstekende uitleg over ionische en covalente bindingen. Ik kijk ernaar uit om meer van deze auteur te lezen.
Ja, het bericht was zeer informatief en gemakkelijk te begrijpen. Ik waardeer de vergelijkingstabel om de verschillen tussen de twee soorten obligaties samen te vatten.
Dit artikel vereenvoudigt het onderwerp, maar er lijkt een ernstig gebrek aan gegevensverwijzingen te zijn. Er kan meer geloofwaardigheid worden gegeven met de juiste citaten
Daar ben ik het mee eens. Ik heb de verstrekte referenties gecontroleerd en het zijn geloofwaardige bronnen.
Ik vond de informatie erg nuttig, vooral voor mijn aanstaande scheikunde-examen
De auteur lijkt zeer goed geïnformeerd te zijn als het om scheikunde gaat. Ik lees graag gedetailleerde berichten zoals deze.
Overeengekomen. De vergelijkingstabel is zeer nuttig bij het benadrukken van het onderscheid tussen ionische en covalente bindingen.
In het artikel worden de onderwerpen uitgelegd die erg nuttig zijn voor inleidend leren.
Dit bericht geeft een uitgebreid overzicht van ionische en covalente bindingen. De voorbeelden zijn zeer nuttig bij het begrijpen van de concepten.
Adequate informatie die waardevol is voor educatieve doeleinden. Een must-read voor middelbare scholieren
De vergelijkingstabel is een geweldige manier om de verschillen te illustreren. Voor iedereen met een basiskennis van scheikunde kan dit artikel een geweldige hulpbron zijn
Daar ben ik het mee eens. De belangrijkste inzichten zijn ook behoorlijk nuttig en vereenvoudigen de concepten.
Het artikel presenteert duidelijk de verschillen tussen ionische en covalente bindingen. Ik vond het erg nuttig.