En chimie, différents composés sont formés par différents types de liaisons entre les molécules.
Divers facteurs déterminent le type de liaison à former entre différentes molécules, et le type de molécules joue un rôle énorme dans la formation de telles liaisons.
Une liaison est une force attractive agissant entre deux molécules.
Faits marquants
- Des liaisons ioniques se forment entre les métaux et les non-métaux par transfert d'électrons, tandis que des liaisons covalentes se forment entre les non-métaux par partage d'électrons.
- Les composés ioniques ont des points de fusion et d'ébullition élevés, tandis que les composés covalents ont des points de fusion et d'ébullition plus bas.
- Les composés ioniques conduisent l'électricité lorsqu'ils sont dissous dans l'eau ou fondus, mais pas les composés covalents.
Liaisons ioniques vs liaison covalente
Des liaisons ioniques se forment entre les atomes par le transfert d'électrons, créant des ions qui sont attirés les uns vers les autres en raison de leurs charges opposées. Les liaisons covalentes impliquent le partage d'électrons entre les atomes, créant une attraction mutuelle qui maintient les atomes ensemble.
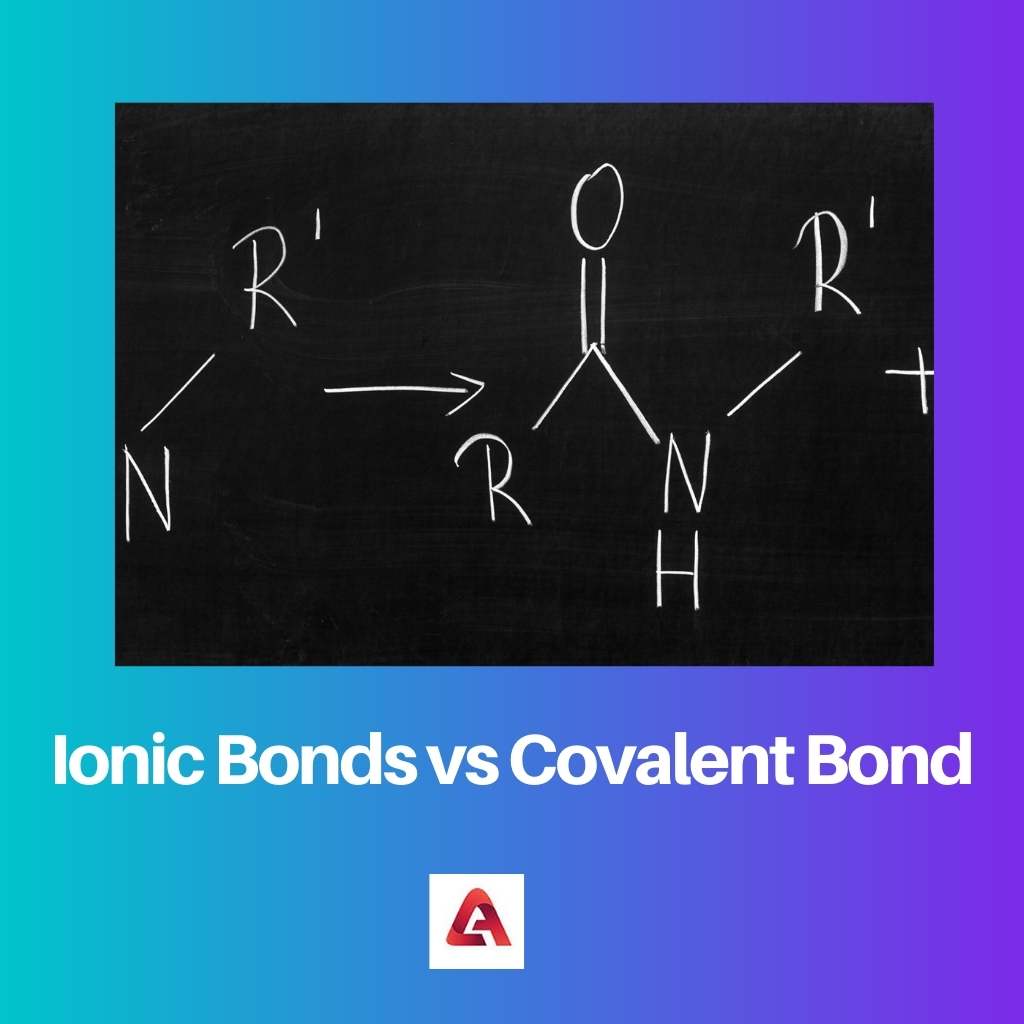
Une liaison ionique est formée dans le cas de composés ioniques. Les composés ioniques sont constitués de molécules contenant des ions chargés, qui peuvent être chargés positivement ou négativement.
Ainsi, cela crée une force d'attraction entre les molécules lorsque des charges opposées s'attirent. Cette force d'attraction se traduit par la formation du lien.
Des liaisons covalentes se forment entre des non-métaux. Ce type de liaison se forme en raison du partage d’électrons entre deux molécules.
Comme l'une des molécules d'un composé covalent est déficiente en électrons, elle reçoit le nombre requis d'électrons des molécules donneuses pour créer un composé covalent stable.
Tableau de comparaison
| Paramètres de comparaison | Liaison ionique | Une liaison covalente |
|---|---|---|
| Création | Les liaisons ioniques se forment en raison du transfert d'ions entre les molécules | Des liaisons covalentes se forment en raison du partage d'électrons entre deux molécules |
| État du composé | Les composés formés ne sont présents qu'à l'état solide | Les composés formés sont présents dans tous les états de la matière |
| Type de molécules | La liaison se produit entre un métal et un non-métal | La liaison se produit entre deux non-métaux |
| Polarité | Les composés ioniques sont non polaires | Les composés covalents sont polaires |
| Point de fusion | Les composés ioniques ont des points de fusion plus élevés | Les composés covalents ont des points de fusion plus bas |
Qu'est-ce qu'Ionic Bond ?
Une liaison ionique est l'un des trois types de liaisons qui se produisent entre les molécules, formant un composé ionique.
La liaison se produit entre un métal et un non-métal, et l'un des exemples les plus courants d'un tel composé est le sel (NaCl), dans lequel le sodium (Na) est un métal et le chlore (Cl) est un non-métal.
C'est une liaison forte et ne peut pas être rompue aussi facilement que dans le cas des liaisons covalentes. La liaison se produit en raison d'un partage d'électrons entre le métal et le non-métal.
L'une des molécules d'un composé ionique est déficiente en électrons, tandis que l'autre molécule est riche en électrons, créant une force d'attraction entre les deux molécules.
La force d'attraction électrostatique entraîne l'interaction entre les deux molécules, partageant les électrons de l'atome riche en électrons vers l'atome déficient en électrons.
L'atome ou la molécule donneur transfère complètement l'atome à la molécule ou à l'atome récepteur, ce qui entraîne une liaison forte et propre entre les deux molécules.
Les caractéristiques de ces composés ioniques sont leurs points de fusion élevés et leur conductivité électrique élevée à l'état fondu ou dissous. Les composés ioniques sont également très solubles dans l'eau.

Qu'est-ce qu'une liaison covalente ?
Une liaison covalente est un type de liaison chimique entre des molécules qui conduit à la formation d'un composé covalent.
C'est le plus faible des trois types de liaisons chimiques, et les molécules d'un composé covalent peuvent être facilement séparées.
Des liaisons covalentes sont formées entre deux non-métaux, et la liaison des métaux des molécules dépend du nombre d'électrons de la couche de valence.
La liaison se produit par partage de paires d'électrons, et ce partage d'électrons se produit pour maintenir l'équilibre chimique entre les molécules ou les atomes.
Le partage d'électrons entre deux molécules instables crée une couche de valence stable dans les deux molécules.
Lorsque les deux atomes ont atteint leur état de valence complète, une liaison se forme entre les deux atomes ou molécules.
La paire d'électrons partagée est présente entre les deux atomes pour maintenir la stabilité du composé.
L'exemple le plus courant d'une liaison covalente est entre les deux atomes d'hydrogène dans une molécule H2.
Dans une molécule H2, les deux atomes d'hydrogène partagent deux électrons conduisant à une liaison covalente.
Le facteur clé requis pour la formation d'une liaison covalente est l'électronégativité des molécules. Deux atomes avec des électronégativités similaires forment une liaison covalente.

Différences principales entre la liaison ionique et covalente
- Les liaisons ioniques se forment en raison du transfert d'ions entre les molécules. Des liaisons covalentes se forment en raison du partage d'électrons entre les atomes.
- Les composés ioniques ne sont présents qu'à l'état solide. Composés covalents sont présents dans tous les états de la matière.
- Une liaison ionique se forme entre un métal et un non-métal. Une liaison covalente se forme entre deux non-métaux.
- Les composés ioniques sont non polaires, alors que les composés covalents sont polaires
- Les composés ioniques ont des points de fusion très élevés, tandis que les composés covalents ont des points de fusion faibles.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Dernière mise à jour : 14 juin 2023

Piyush Yadav a passé les 25 dernières années à travailler comme physicien dans la communauté locale. C'est un physicien passionné par l'idée de rendre la science plus accessible à nos lecteurs. Il est titulaire d'un baccalauréat en sciences naturelles et d'un diplôme d'études supérieures en sciences de l'environnement. Vous pouvez en savoir plus sur lui sur son page bio.


Informations fascinantes sur les liaisons ioniques et covalentes, la quantité d'informations détaillées dans l'article est remarquable et très facile à comprendre
Article intéressant. J'apprécie la discussion approfondie sur les caractéristiques des composés ioniques et covalents.
Je ne suis pas d'accord. Les liaisons covalentes ne sont pas nécessairement les plus faibles des trois types de liaisons chimiques. Il existe des cas où elles sont plus fortes que les liaisons ioniques.
C'est vrai dans certaines circonstances, mais en général, cette affirmation est valable. Les liaisons covalentes sont considérées comme les plus faibles en raison de la facilité de rupture de la liaison.
Excellente explication sur les liaisons ioniques et covalentes. J'ai hâte de lire davantage de cet auteur.
Oui, le message était très instructif et facile à comprendre. J'apprécie le tableau comparatif pour résumer les différences entre les deux types d'obligations.
Cet article simplifie le sujet mais il semble y avoir un sérieux manque de référencement des données. Plus de crédibilité peut être donnée avec des citations appropriées
Je suis d'accord. J'ai vérifié les références fournies et ce sont des sources crédibles.
J'ai trouvé les informations très utiles, en particulier pour mon prochain examen de chimie.
L'auteur semble être très compétent en matière de chimie. J'aime lire des articles détaillés comme celui-ci.
Convenu. Le tableau de comparaison est très utile pour mettre en évidence les distinctions entre les liaisons ioniques et covalentes.
L'article explique les sujets qui sont très utiles pour l'apprentissage d'introduction.
Cet article fournit un aperçu complet des liaisons ioniques et covalentes. Les exemples sont très utiles pour comprendre les concepts.
Informations adéquates et précieuses à des fins éducatives. Une lecture incontournable pour les lycéens
Le tableau comparatif est un excellent moyen d'illustrer les différences. Pour toute personne ayant des connaissances de base en chimie, cet article pourrait être une ressource formidable.
Je suis d'accord. Les principaux points à retenir sont également très utiles et simplifient les concepts.
L'article présente clairement les différences entre les liaisons ioniques et covalentes. Je l'ai trouvé très utile.