रसायन विज्ञान में, अणुओं के बीच विभिन्न प्रकार के बंधनों से विभिन्न यौगिक बनते हैं।
विभिन्न कारक यह निर्धारित करते हैं कि विभिन्न अणुओं के बीच किस प्रकार का बंधन बनना चाहिए और अणुओं का प्रकार ऐसे बंधनों के निर्माण में बहुत बड़ी भूमिका निभाता है।
बंधन दो अणुओं के बीच कार्य करने वाला एक आकर्षक बल है।
चाबी छीन लेना
- आयनिक बंधन धातुओं और गैर-धातुओं के बीच इलेक्ट्रॉनों के स्थानांतरण के माध्यम से बनते हैं, जबकि सहसंयोजक बंधन गैर-धातुओं के बीच इलेक्ट्रॉन साझाकरण के माध्यम से बनते हैं।
- आयनिक यौगिकों का गलनांक और क्वथनांक उच्च होता है, जबकि सहसंयोजक यौगिकों का गलनांक और क्वथनांक कम होता है।
- आयनिक यौगिक पानी में घुलने या पिघलने पर बिजली का संचालन करते हैं, लेकिन सहसंयोजक यौगिक ऐसा नहीं करते हैं।
आयनिक बांड बनाम सहसंयोजक बांड
इलेक्ट्रॉनों के स्थानांतरण के माध्यम से परमाणुओं के बीच आयनिक बंधन बनते हैं, जिससे ऐसे आयन बनते हैं जो अपने विपरीत आवेशों के कारण एक दूसरे की ओर आकर्षित होते हैं। सहसंयोजक बंधन में परमाणुओं के बीच इलेक्ट्रॉनों का आदान-प्रदान शामिल होता है, जिससे एक पारस्परिक आकर्षण पैदा होता है जो परमाणुओं को एक साथ रखता है।
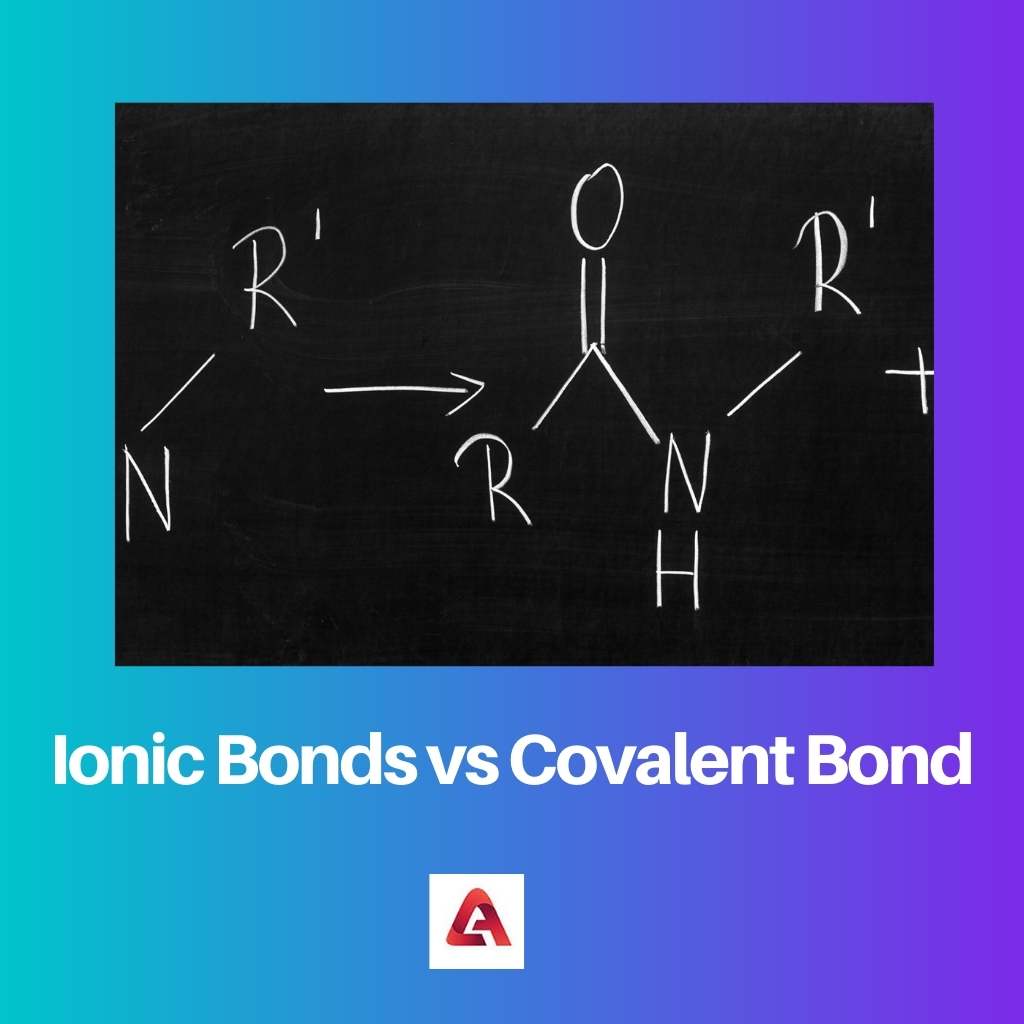
आयनिक यौगिकों के मामले में एक आयनिक बंधन बनता है। आयनिक यौगिक आवेशित आयनों वाले अणुओं से बने होते हैं, जो धनात्मक या ऋणात्मक रूप से आवेशित हो सकते हैं।
इस प्रकार यह अणुओं के बीच आकर्षण बल पैदा करता है क्योंकि विपरीत आवेश एक दूसरे को आकर्षित करते हैं। आकर्षण के इस बल के परिणामस्वरूप बंधन का निर्माण होता है।
अधातुओं के बीच सहसंयोजक बंधन बनते हैं। इस प्रकार का बंधन दो अणुओं के बीच इलेक्ट्रॉनों के बंटवारे के कारण बनता है।
चूँकि सहसंयोजक यौगिक में एक अणु में इलेक्ट्रॉन की कमी होती है, यह एक स्थिर सहसंयोजक यौगिक बनाने के लिए दाता अणुओं से आवश्यक संख्या में इलेक्ट्रॉन प्राप्त करता है।
तुलना तालिका
| तुलना के पैरामीटर | आयोनिक बंध | सहसंयोजक बंधन |
|---|---|---|
| निर्माण | आयनिक बंधन अणुओं के बीच आयनों के स्थानांतरण के कारण बनते हैं | सहसंयोजक बंधन दो अणुओं के बीच इलेक्ट्रॉनों के बंटवारे के कारण बनते हैं |
| यौगिक की अवस्था | बनने वाले यौगिक केवल ठोस अवस्था में मौजूद होते हैं | बनने वाले यौगिक पदार्थ की सभी अवस्थाओं में मौजूद होते हैं |
| अणुओं के प्रकार | बंधन धातु और अधातु के बीच होता है | आबंधन दो अधातुओं के बीच होता है |
| ध्रुवाभिसारिता | आयनिक यौगिक अध्रुवीय होते हैं | सहसंयोजक यौगिक ध्रुवीय होते हैं |
| गलनांक | आयनिक यौगिकों का गलनांक अधिक होता है | सहसंयोजक यौगिकों का गलनांक कम होता है |
आयनिक बांड क्या है?
आयनिक बंधन तीन प्रकार के बंधनों में से एक है जो अणुओं के बीच होता है, जिससे एक आयनिक यौगिक बनता है।
बंधन एक धातु और एक गैर-धातु के बीच होता है, और ऐसे यौगिक का सबसे आम उदाहरण नमक (NaCl) है, जिसमें सोडियम (Na) एक धातु है और क्लोरीन (Cl) एक गैर-धातु है।
यह एक मजबूत बंधन है और इसे सहसंयोजक बंधन की तरह आसानी से नहीं तोड़ा जा सकता है। बंधन धातु और गैर-धातु के बीच इलेक्ट्रॉनों के बंटवारे के कारण होता है।
आयनिक यौगिक में एक अणु में इलेक्ट्रॉन की कमी होती है, जबकि दूसरे अणु में इलेक्ट्रॉन प्रचुर होता है, जिससे दोनों अणुओं के बीच आकर्षण बल पैदा होता है।
इलेक्ट्रोस्टैटिक आकर्षण बल के परिणामस्वरूप दो अणुओं के बीच परस्पर क्रिया होती है, जिससे इलेक्ट्रॉन-समृद्ध परमाणु से इलेक्ट्रॉन-कमी वाले परमाणु में इलेक्ट्रॉनों का आदान-प्रदान होता है।
दाता परमाणु या अणु पूरी तरह से परमाणु को प्राप्तकर्ता अणु या परमाणु में स्थानांतरित कर देता है, जिसके परिणामस्वरूप दोनों अणुओं के बीच एक मजबूत और साफ बंधन बनता है।
ऐसे आयनिक यौगिकों की विशेषताएं उनके उच्च गलनांक और पिघली हुई या विघटित अवस्था में उच्च विद्युत चालकता हैं। आयनिक यौगिक भी पानी में अत्यधिक घुलनशील होते हैं।

सहसंयोजक बंधन क्या है?
सहसंयोजक बंधन अणुओं के बीच एक प्रकार का रासायनिक बंधन है जो सहसंयोजक यौगिक के निर्माण की ओर ले जाता है।
यह तीन प्रकार के रासायनिक बंधनों में सबसे कमजोर है, और सहसंयोजक यौगिक में अणुओं को आसानी से अलग किया जा सकता है।
सहसंयोजक बंधन दो अधातुओं के बीच बनते हैं और धातुओं के अणुओं का बंधन संयोजकता कोश में इलेक्ट्रॉनों की संख्या पर निर्भर करता है।
बंधन इलेक्ट्रॉन जोड़े के बंटवारे से होता है, और इलेक्ट्रॉनों का यह बंटवारा अणुओं या परमाणुओं के बीच रासायनिक संतुलन बनाए रखने के लिए होता है।
दो अस्थिर अणुओं के बीच इलेक्ट्रॉनों का बंटवारा दोनों अणुओं में एक स्थिर वैलेंस शेल बनाता है।
जब दोनों परमाणु अपनी पूर्ण संयोजकता अवस्था में पहुंच जाते हैं, तो दोनों परमाणुओं या अणुओं के बीच एक बंधन बनता है।
यौगिक की स्थिरता बनाए रखने के लिए दोनों परमाणुओं के बीच इलेक्ट्रॉनों की साझा जोड़ी मौजूद होती है।
सहसंयोजक बंधन का सबसे आम उदाहरण H2 अणु में दो हाइड्रोजन परमाणुओं के बीच है।
एक H2 अणु में, दो हाइड्रोजन परमाणु दो इलेक्ट्रॉनों को साझा करते हैं जिससे एक सहसंयोजक बंधन बनता है।
सहसंयोजक बंधन के निर्माण के लिए आवश्यक मुख्य कारक अणुओं की इलेक्ट्रोनगेटिविटी है। समान इलेक्ट्रोनगेटिविटी वाले दो परमाणुओं के परिणामस्वरूप सहसंयोजक बंधन बनता है।

आयनिक और सहसंयोजक बंधन के बीच मुख्य अंतर
- आयनिक बंधन अणुओं के बीच आयनों के स्थानांतरण के कारण बनते हैं। सहसंयोजक बंधन परमाणुओं के बीच इलेक्ट्रॉनों के बंटवारे के कारण बनते हैं।
- आयनिक यौगिक केवल ठोस अवस्था में मौजूद होते हैं। सहसंयोजक यौगिक पदार्थ की सभी अवस्थाओं में मौजूद हैं।
- एक धातु और एक अधातु के बीच एक आयनिक बंधन बनता है। दो अधातुओं के बीच सहसंयोजक बंधन बनता है।
- आयनिक यौगिक गैर-ध्रुवीय होते हैं, जबकि सहसंयोजक यौगिक ध्रुवीय होते हैं
- आयनिक यौगिकों का गलनांक बहुत अधिक होता है, जबकि सहसंयोजक यौगिकों का गलनांक कम होता है।
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
अंतिम अद्यतन: 14 जून, 2023

पीयूष यादव ने पिछले 25 साल स्थानीय समुदाय में भौतिक विज्ञानी के रूप में काम करते हुए बिताए हैं। वह एक भौतिक विज्ञानी हैं जो विज्ञान को हमारे पाठकों के लिए अधिक सुलभ बनाने के लिए उत्सुक हैं। उनके पास प्राकृतिक विज्ञान में बीएससी और पर्यावरण विज्ञान में स्नातकोत्तर डिप्लोमा है। आप उनके बारे में और अधिक पढ़ सकते हैं जैव पृष्ठ.


आयनिक और सहसंयोजक बंधों के बारे में आकर्षक जानकारी, लेख में विस्तृत जानकारी की मात्रा उल्लेखनीय है और समझने में बहुत आसान है
दिलचस्प आलेख। मैं आयनिक और सहसंयोजक यौगिकों की विशेषताओं के बारे में गहन चर्चा की सराहना करता हूं।
मैं असहमत हूं। जरूरी नहीं कि सहसंयोजक बंधन तीन प्रकार के रासायनिक बंधनों में सबसे कमजोर हों। ऐसे मामले हैं जहां वे आयनिक बंधों से अधिक मजबूत हैं।
कुछ परिस्थितियों में यह सच है, लेकिन आम तौर पर यह कथन सत्य है। बंधन तोड़ने में आसानी के कारण सहसंयोजक बंधन सबसे कमजोर माने जाते हैं।
आयनिक और सहसंयोजक बंधों पर उत्कृष्ट व्याख्या। मैं इस लेखक से और अधिक पढ़ने के लिए उत्सुक हूं।
हां, पोस्ट बहुत जानकारीपूर्ण और समझने में आसान थी। मैं दो प्रकार के बांडों के बीच अंतर को सारांशित करने के लिए तुलना तालिका की सराहना करता हूं।
यह आलेख विषय को सरल बनाता है लेकिन इसमें डेटा संदर्भ का गंभीर अभाव प्रतीत होता है। उचित उद्धरणों से अधिक विश्वसनीयता प्रदान की जा सकती है
मैं सहमत हूं। मैंने दिए गए संदर्भों की जाँच की और वे विश्वसनीय स्रोत हैं।
मुझे यह जानकारी बहुत उपयोगी लगी, विशेषकर मेरी आगामी रसायन विज्ञान परीक्षा के लिए
जब रसायन विज्ञान की बात आती है तो लेखक बहुत जानकार प्रतीत होता है। मुझे इस तरह की विस्तृत पोस्ट पढ़ने में मजा आता है।
मान गया। तुलना तालिका आयनिक और सहसंयोजक बंधों के बीच अंतर को उजागर करने में बहुत सहायक है।
लेख उन विषयों की व्याख्या करता है जो परिचयात्मक शिक्षण के लिए बहुत उपयोगी हैं।
यह पोस्ट आयनिक और सहसंयोजक बंधों का एक व्यापक अवलोकन प्रदान करता है। अवधारणाओं को समझने में उदाहरण बहुत सहायक होते हैं।
पर्याप्त जानकारी जो शैक्षिक उद्देश्यों के लिए मूल्यवान है। हाई स्कूल के छात्रों के लिए अवश्य पढ़ें
तुलना तालिका मतभेदों को दर्शाने का एक शानदार तरीका है, रसायन विज्ञान का बुनियादी ज्ञान रखने वाले किसी भी व्यक्ति के लिए यह लेख एक अद्भुत संसाधन हो सकता है
मैं सहमत हूं। मुख्य बातें भी काफी सहायक हैं और अवधारणाओं को सरल बनाती हैं।
लेख आयनिक और सहसंयोजक बंधों के बीच अंतर को स्पष्ट रूप से प्रस्तुत करता है। मैंने इसे बहुत उपयोगी पाया।