सहसंयोजक और हाइड्रोकार्बन बंधन के बीच कई महत्वपूर्ण अंतर हैं। रसायन विज्ञान, पदार्थों - तत्वों और यौगिकों का अध्ययन, दो परमाणुओं और अणुओं के बीच बंधन की मूल बातें से शुरू होता है।
यह लेख हाइड्रोजन और सहसंयोजक बंधों के बीच अंतर और वे कैसे बनते हैं, समझाएगा। हम दो प्रकार के रासायनिक बंधों को देखेंगे। अंतःक्रिया प्रकार एक सहसंयोजक अणु को हाइड्रोकार्बन अणु से अलग बनाता है।
चाबी छीन लेना
- अणुओं के बीच हाइड्रोजन बंधन तब बनते हैं जब एक हाइड्रोजन परमाणु एक अत्यधिक विद्युत ऋणात्मक परमाणु से बंधता है; सहसंयोजक बंधन एक अणु के भीतर परमाणुओं के बीच इलेक्ट्रॉनों को साझा करते हैं।
- हाइड्रोजन बांड सहसंयोजक बांड की तुलना में कमजोर होते हैं, जो अस्थायी और प्रतिवर्ती इंटरैक्शन प्रदान करते हैं।
- हाइड्रोजन बांड जैविक अणुओं की संरचना और कार्य में योगदान करते हैं; सहसंयोजक बंधन आणविक संरचनाओं का आधार बनते हैं।
हाइड्रोजन बॉन्ड बनाम सहसंयोजक बॉन्ड
हाइड्रोजन बांड तब उत्पन्न होते हैं जब एक सकारात्मक रूप से चार्ज किया गया हाइड्रोजन परमाणु एक इलेक्ट्रोनगेटिव परमाणु के साथ संपर्क करता है, जिससे सहसंयोजक बांड की तुलना में अपेक्षाकृत कमजोर बंधन बनता है जिसमें इलेक्ट्रॉन साझाकरण शामिल होता है। ये बंधन पानी के अद्वितीय गुणों के लिए आवश्यक हैं। सहसंयोजक बंधन अधिकांश अणुओं की नींव बनाते हैं।

हाइड्रोजन बंधन या तो इंट्रामोल्युलर या इंटरमॉलिक्युलर हो सकता है। हाइड्रोजन बांड से जुड़ी ऊर्जा ज्यामिति और परमाणुओं के वातावरण के आधार पर भिन्न होती है।
यह कार्बनिक और अकार्बनिक अणुओं में होने वाली वैन डेर वाल्स इंटरैक्शन की तुलना में एक कमजोर बंधन है। हाइड्रोजन बांड के कुछ उदाहरण सैलिसिलिक एसिड, एच2ओ (पानी), मिथाइल अल्कोहल, चीनी आदि हैं।
सहसंयोजक बंधन अंतर-आणविक बलों के रूप हैं। वे तब बनते हैं जब दो या दो से अधिक परमाणु अपने सबसे बाहरी इलेक्ट्रॉन कोश को भरने के लिए अपने इलेक्ट्रॉनों को साझा करते हैं। सहसंयोजक बंधन हाइड्रोजन बांड की तुलना में अधिक मजबूत होते हैं और इनमें उच्च स्थिरता होती है।
तुलना तालिका
| तुलना के पैरामीटर | हाइड्रोजन बंध | सहसंयोजक बंधन |
|---|---|---|
| वे क्या हैं? | एक हाइड्रोजन बंधन एक हाइड्रोजन परमाणु और एक अधिक विद्युतीय परमाणु के बीच आकर्षण का बल है। | सहसंयोजक बंधन इलेक्ट्रॉनों के बंटवारे से बनने वाले रासायनिक बंधन हैं। |
| ताकतों | इंटरमॉलिक्युलर और इंट्रामोल्युलर फोर्स। | अंतर आणविक बल। |
| शक्ति | यह दो परमाणुओं के बीच बनता है। | हाइड्रोजन बांड की तुलना में सहसंयोजक बंधन अधिक मजबूत होते हैं। |
| के बीच बना | दो अलग-अलग अणुओं के दो परमाणुओं के बीच एक हाइड्रोजन बंधन बनता है। | दो परमाणुओं के बीच बना। |
| उदाहरण | सैलिसिलिक एसिड, पानी, ग्लूकोज, आदि। | मीथेन, कार्बन मोनोऑक्साइड, आदि। |
हाइड्रोजन बॉन्ड क्या है?
हाइड्रोजन बंधन दो परमाणुओं के बीच आकर्षण का एक विद्युत बल है। यह तब बनता है जब एक हाइड्रोजन परमाणु सहसंयोजक रूप से किसी अन्य अधिक विद्युत ऋणात्मक बिट, जैसे ऑक्टेट या समूह के साथ बंधता है।
अधिकतर, इलेक्ट्रोनगेटिव अणु या तो ऑक्सीजन, नाइट्रोजन या फ्लोरीन होते हैं। ज्यादातर मामलों में, इलेक्ट्रॉनों की एक अकेली जोड़ी के साथ एक अधिक विद्युतीय परमाणु को स्वीकर्ता कहा जाता है।
हाइड्रोजन बांड आंशिक रूप से सकारात्मक और सकारात्मक रूप से चार्ज किए गए परमाणुओं के बीच मजबूत आकर्षण हैं। वे सभी ज्ञात प्रकार के बंधनों में सबसे मजबूत हैं। ये बंधन अनेकों में पाए जाते हैं सहसंयोजक यौगिक लेकिन सहसंयोजक की तुलना में कमजोर हैं।
हाइड्रोजन परमाणु की विद्युत ऋणात्मक प्रकृति दो अणुओं को एक साथ बांधती है। इसलिए पानी कणों के बीच गति कर सकता है और स्थिर रासायनिक यौगिक बना सकता है। उदाहरण के लिए, जब गीली कागज़ की शीटें आपस में चिपक जाती हैं।
हाइड्रोजन बंधन एक ही प्रकार के हाइड्रोजन वाले दो अणुओं के बीच होते हैं।
सीएच बांड तब बनते हैं जब दो कार्बन परमाणु बन जाते हैं वैद्युतीयऋणात्मकता बाध्य।
दाता/स्वीकर्ता बंधन में, प्रोटॉन दाता विद्युत ऋणात्मक परमाणु होता है, और प्रोटॉन स्वीकर्ता वह होता है जो हाइड्रोजन के साथ सहसंयोजक रूप से बंधा नहीं होता है। आधार युग्म में हाइड्रोजन परमाणु हाइड्रोजन बंधन द्वारा एक साथ बंधे रहते हैं।
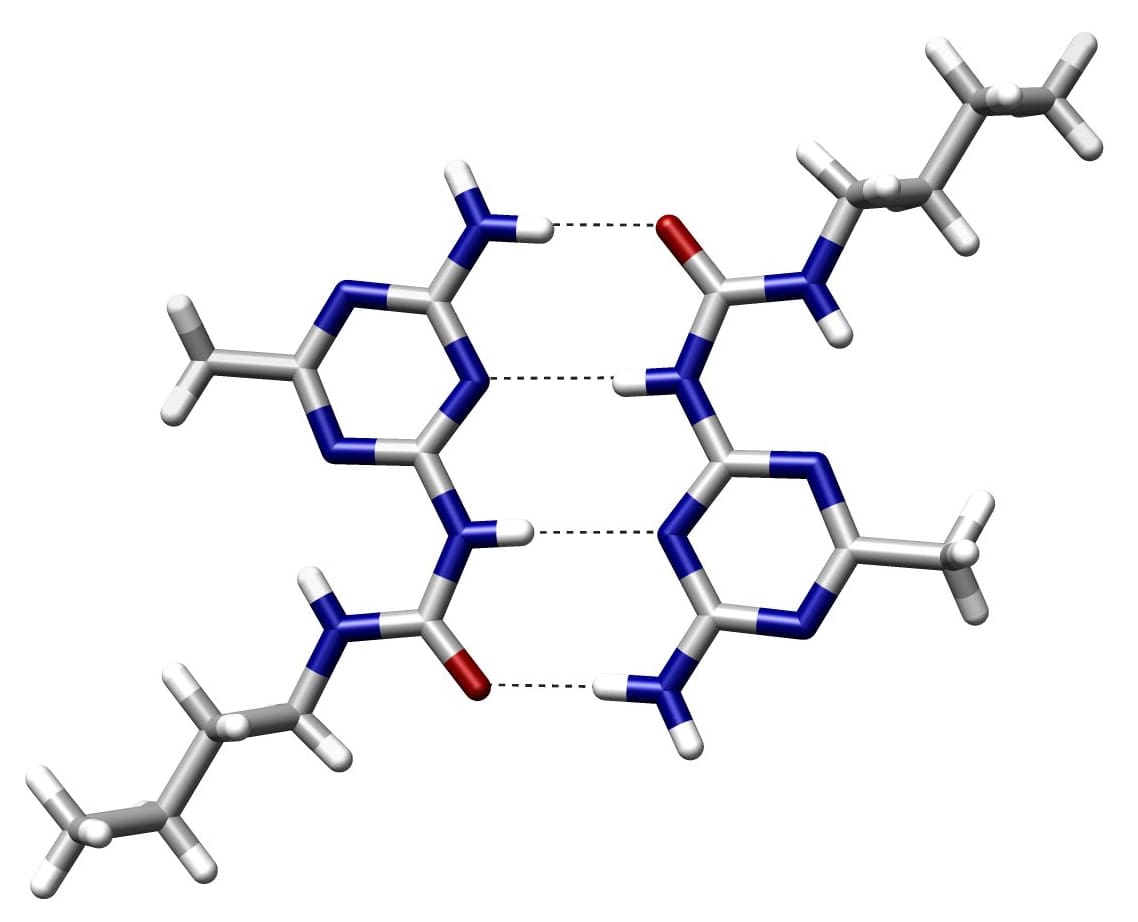
एक सहसंयोजक बंधन क्या है?
सहसंयोजक बंधन बनाने के लिए दो परमाणु इलेक्ट्रॉन जोड़े साझा करते हैं। इन इलेक्ट्रॉन युग्मों को आबंध युग्म कहते हैं। सहसंयोजक बंधन आकर्षक और प्रतिकारक शक्तियों के संतुलन के माध्यम से बनाए जाते हैं।
यहां कुछ उदाहरण दिए गए हैं। उदाहरण के लिए, यहाँ एक रासायनिक समीकरण है। उनके पीछे के विज्ञान को जानने के लिए आगे पढ़ें। सहसंयोजक बंधन का सबसे सरल उदाहरण इलेक्ट्रॉनों की एक जोड़ी को साझा करना है।
बंधन प्रक्रिया में दो अलग-अलग परमाणुओं के बीच इलेक्ट्रॉनों को साझा करना शामिल है। क्योंकि इलेक्ट्रॉन ऊर्जा साझा करते हैं, उनमें अन्य परमाणुओं की तुलना में कम ऊर्जा हो सकती है। जब केन्द्र एक दूसरे को आकर्षित करते हैं तो वे उलझ जाते हैं।
“साझा इलेक्ट्रॉन दूसरे परमाणु की ऊर्जा को कम कर देते हैं। इसे "संतुलन" कहा जाता है। यह घटना आम है और इसका उपयोग प्रगति को ट्रैक करने और आवश्यक पाठों की पहचान करने के लिए किया जा सकता है। साझा इलेक्ट्रॉन दूसरे परमाणु की ऊर्जा को कम करते हैं। इसे "संतुलन" कहा जाता है। यह घटना आम है और इसका उपयोग प्रगति को ट्रैक करने और आवश्यक पाठों की पहचान करने के लिए किया जा सकता है।
इलेक्ट्रॉनों को साझा करने की प्रक्रिया के परिणामस्वरूप ऊर्जा में कमी आती है। जो इलेक्ट्रॉन एक परमाणु को दूसरे इलेक्ट्रॉन के साथ साझा करता है वह शक्ति खो देगा। इसी अवस्था में सहसंयोजक बंधन बनता है।
दो आकर्षक केंद्रों के बीच के इलेक्ट्रॉन में दो तटस्थ केंद्रों के बीच के इलेक्ट्रॉन की तुलना में कम ऊर्जा होती है। एक अणु में एक परमाणु की शक्ति बढ़ जाती है यदि इसे उच्च ऊर्जा स्तर वाले बिट के साथ साझा किया जाए।
हाइड्रोजन बॉन्ड और सहसंयोजक बॉन्ड के बीच मुख्य अंतर
- एक हाइड्रोजन बंधन एक सहसंयोजक बंधन से केवल 1/10 गुना अधिक मजबूत होता है।
- हाइड्रोजन बॉन्ड इंट्रामोल्युलर और इंटरमॉलिक्युलर बॉन्ड हैं। दूसरी ओर, सहसंयोजक बंधन इंटरमॉलिक्युलर रासायनिक बंधन हैं।
- हाइड्रोजन बांड दो अलग-अलग अणुओं के दो परमाणुओं के बीच बनते हैं। सहसंयोजक बंधन दो परमाणुओं के बीच बनते हैं।
- हाइड्रोजन बांड आकर्षण बल हैं। सहसंयोजक बंधन रासायनिक बंधन हैं।
- सहसंयोजक बंधों की तुलना में हाइड्रोजन बंधों की स्थिरता कम होती है।
- https://scripts.iucr.org/cgi-bin/paper?a12816
- https://pubs.acs.org/doi/pdf/10.1021/ja01130a013
- https://aip.scitation.org/doi/abs/10.1063/1.3159673
अंतिम अद्यतन: 29 जून, 2023

पीयूष यादव ने पिछले 25 साल स्थानीय समुदाय में भौतिक विज्ञानी के रूप में काम करते हुए बिताए हैं। वह एक भौतिक विज्ञानी हैं जो विज्ञान को हमारे पाठकों के लिए अधिक सुलभ बनाने के लिए उत्सुक हैं। उनके पास प्राकृतिक विज्ञान में बीएससी और पर्यावरण विज्ञान में स्नातकोत्तर डिप्लोमा है। आप उनके बारे में और अधिक पढ़ सकते हैं जैव पृष्ठ.


वैज्ञानिक व्याख्या स्पष्ट और सटीक है। इससे मुझे अवधारणा को बेहतर तरीके से समझने में मदद मिली है।
हाइड्रोजन और सहसंयोजक बंधों की तुलना अच्छी तरह से समझाई गई है। बढ़िया लेख!
हां, मैं पूरी तरह सहमत हूं. यह रसायन विज्ञान में रुचि रखने वाले छात्रों और अन्य लोगों के लिए फायदेमंद है।
यह लेख हाइड्रोजन और सहसंयोजक बंधों के बीच अंतर का गहन विश्लेषण प्रदान करता है।
लेखक ने प्रासंगिक उदाहरणों के साथ अवधारणाओं को समझाने में उत्कृष्ट काम किया है। यह सराहनीय है.
इस लेख को पढ़ना वास्तव में समृद्ध करने वाला था। यहां दी गई तुलना से मुझे बहुमूल्य अंतर्दृष्टि और ज्ञान प्राप्त हुआ है।
मैं उल्लिखित कुछ बिंदुओं के समर्थन में कुछ और वैज्ञानिक प्रमाणों की अपेक्षा कर रहा था। अच्छा है, लेकिन बढ़िया नहीं.