Trong Hóa học, các hợp chất khác nhau được hình thành bởi các loại liên kết khác nhau giữa các phân tử.
Các yếu tố khác nhau xác định loại liên kết nào sẽ được hình thành giữa các phân tử khác nhau và loại phân tử đóng vai trò rất lớn trong việc hình thành các liên kết đó.
Liên kết là lực hấp dẫn tác dụng giữa hai phân tử.
Chìa khóa chính
- Liên kết ion hình thành giữa kim loại và phi kim thông qua sự chuyển electron, trong khi liên kết cộng hóa trị hình thành giữa các phi kim thông qua chia sẻ electron.
- Các hợp chất ion có điểm nóng chảy và sôi cao, trong khi các hợp chất cộng hóa trị có điểm nóng chảy và sôi thấp hơn.
- Các hợp chất ion dẫn điện khi hòa tan trong nước hoặc nóng chảy, nhưng các hợp chất cộng hóa trị thì không.
Liên kết ion vs Liên kết cộng hóa trị
Liên kết ion được hình thành giữa các nguyên tử thông qua sự chuyển dịch electron, tạo ra các ion hút nhau do mang điện tích trái dấu. Liên kết cộng hóa trị liên quan đến việc chia sẻ các electron giữa các nguyên tử, tạo ra lực hút lẫn nhau giữ các nguyên tử lại với nhau.
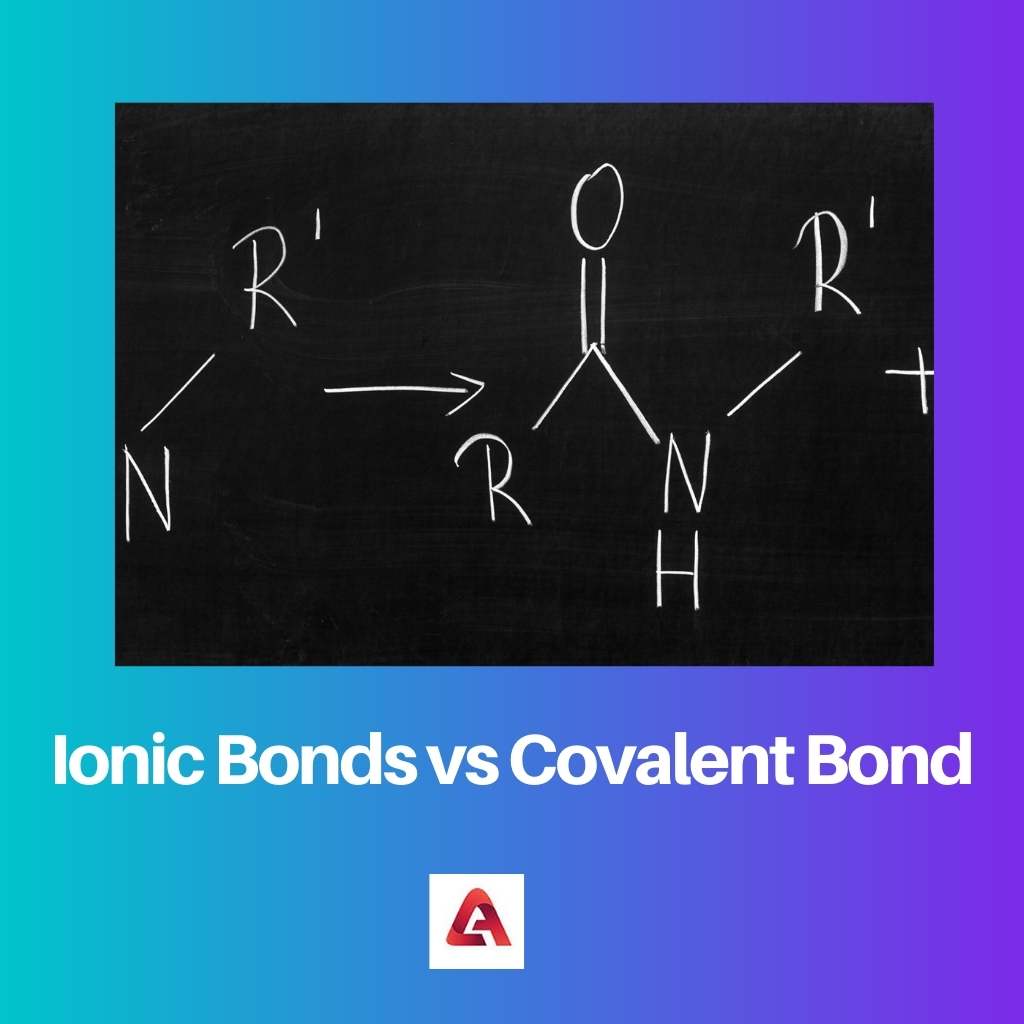
Một liên kết ion được hình thành trong trường hợp các hợp chất ion. Các hợp chất ion được tạo thành từ các phân tử chứa các ion tích điện, có thể tích điện dương hoặc âm.
Do đó, điều này tạo ra lực hút giữa các phân tử khi các điện tích trái dấu hút nhau. Lực hấp dẫn này dẫn đến sự hình thành liên kết.
Liên kết cộng hóa trị được hình thành giữa các phi kim loại. Loại liên kết này được hình thành do sự chia sẻ electron giữa hai phân tử.
Vì một trong các phân tử trong hợp chất cộng hóa trị bị thiếu điện tử nên nó nhận số lượng điện tử cần thiết từ các phân tử cho để tạo ra hợp chất cộng hóa trị ổn định.
Bảng so sánh
| Các thông số so sánh | Sự gắn kết | Trái phiếu cộng hóa trị |
|---|---|---|
| Sáng tạo | Liên kết ion được hình thành do sự chuyển dịch ion giữa các phân tử | Liên kết cộng hóa trị được hình thành do sự góp chung electron giữa hai phân tử |
| trạng thái hợp chất | Các hợp chất được hình thành chỉ tồn tại ở trạng thái rắn | Các hợp chất được hình thành có mặt trong tất cả các trạng thái của vật chất |
| Loại phân tử | Liên kết xảy ra giữa kim loại và phi kim | Liên kết xảy ra giữa hai phi kim |
| Polarity | Hợp chất ion không phân cực | Hợp chất cộng hóa trị có cực |
| điểm nóng chảy | Hợp chất ion có nhiệt độ nóng chảy cao hơn | Hợp chất cộng hóa trị có điểm nóng chảy thấp hơn |
Liên kết ion là gì?
Liên kết ion là một trong ba loại liên kết xảy ra giữa các phân tử, tạo thành hợp chất ion.
Liên kết xảy ra giữa kim loại và phi kim, và một trong những ví dụ phổ biến nhất của hợp chất như vậy là muối (NaCl), trong đó Natri (Na) là kim loại và Clo (Cl) là phi kim.
Nó là một liên kết mạnh và không thể bị phá vỡ dễ dàng như trong trường hợp liên kết cộng hóa trị. Liên kết xảy ra do sự dùng chung electron giữa kim loại và phi kim.
Một trong những phân tử trong hợp chất ion bị thiếu điện tử, trong khi phân tử kia giàu điện tử, tạo ra lực hút giữa hai phân tử.
Lực hút tĩnh điện dẫn đến sự tương tác giữa hai phân tử, chia sẻ các electron từ nguyên tử giàu electron sang nguyên tử thiếu electron.
Nguyên tử hoặc phân tử cho chuyển hoàn toàn nguyên tử sang phân tử hoặc nguyên tử nhận, dẫn đến liên kết mạnh và sạch giữa hai phân tử.
Đặc điểm của các hợp chất ion như vậy là điểm nóng chảy cao và tính dẫn điện cao ở trạng thái nóng chảy hoặc hòa tan. Các hợp chất ion cũng hòa tan cao trong nước.

Trái phiếu cộng hóa trị là gì?
Liên kết cộng hóa trị là một loại liên kết hóa học giữa các phân tử dẫn đến sự hình thành hợp chất cộng hóa trị.
Đây là loại liên kết yếu nhất trong ba loại liên kết hóa học và các phân tử trong hợp chất cộng hóa trị có thể dễ dàng tách ra.
Liên kết cộng hóa trị được hình thành giữa hai phi kim và liên kết giữa các kim loại của các phân tử phụ thuộc vào số lượng lớp vỏ hóa trị của electron.
Liên kết xảy ra bằng cách chia sẻ các cặp electron và việc chia sẻ các electron này xảy ra để duy trì sự cân bằng hóa học giữa các phân tử hoặc nguyên tử.
Việc chia sẻ các electron giữa hai phân tử không ổn định tạo ra lớp vỏ hóa trị ổn định trong cả hai phân tử.
Khi cả hai nguyên tử đều đạt đến trạng thái hóa trị đầy đủ, một liên kết được hình thành giữa hai nguyên tử hoặc phân tử.
Cặp electron dùng chung có mặt giữa cả hai nguyên tử để duy trì sự ổn định của hợp chất.
Ví dụ phổ biến nhất về liên kết cộng hóa trị là giữa hai nguyên tử Hydro trong phân tử H2.
Trong một phân tử H2, hai nguyên tử Hydrogen chia sẻ hai electron dẫn đến liên kết cộng hóa trị.
Yếu tố chính cần thiết cho sự hình thành liên kết cộng hóa trị là độ âm điện của các phân tử. Hai nguyên tử có độ âm điện tương tự nhau tạo thành liên kết cộng hóa trị.

Sự khác biệt chính giữa liên kết ion và cộng hóa trị
- Liên kết ion được hình thành do sự chuyển ion giữa các phân tử. Liên kết cộng hóa trị được hình thành do sự dùng chung electron giữa các nguyên tử.
- Hợp chất ion chỉ tồn tại ở trạng thái rắn. Hợp chất cộng hóa trị có mặt trong mọi trạng thái của vật chất.
- Liên kết ion được hình thành giữa kim loại và phi kim. Một liên kết cộng hóa trị được hình thành giữa hai phi kim loại.
- Các hợp chất ion là không phân cực, trong khi các hợp chất cộng hóa trị là cực
- Các hợp chất ion có điểm nóng chảy rất cao, trong khi các hợp chất cộng hóa trị có điểm nóng chảy thấp.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Cập nhật lần cuối: ngày 14 tháng 2023 năm XNUMX

Piyush Yadav đã dành 25 năm qua làm việc với tư cách là một nhà vật lý trong cộng đồng địa phương. Anh ấy là một nhà vật lý đam mê làm cho khoa học dễ tiếp cận hơn với độc giả của chúng tôi. Ông có bằng Cử nhân Khoa học Tự nhiên và Bằng Sau Đại học về Khoa học Môi trường. Bạn có thể đọc thêm về anh ấy trên trang sinh học.


Thông tin hấp dẫn về liên kết ion và cộng hóa trị, lượng thông tin chi tiết trong bài rất đáng chú ý và rất dễ hiểu
Bài báo thú vị. Tôi đánh giá cao cuộc thảo luận chuyên sâu về đặc tính của các hợp chất ion và cộng hóa trị.
Tôi không đồng ý. Liên kết cộng hóa trị không nhất thiết phải là liên kết yếu nhất trong ba loại liên kết hóa học. Có những trường hợp chúng mạnh hơn liên kết ion.
Điều đó đúng trong một số trường hợp nhất định, nhưng nhìn chung, tuyên bố này đúng. Liên kết cộng hóa trị được coi là yếu nhất do dễ bị phá vỡ.
Giải thích tuyệt vời về liên kết ion và cộng hóa trị. Tôi mong muốn được đọc thêm từ tác giả này.
Vâng, bài viết rất nhiều thông tin và dễ hiểu. Tôi đánh giá cao bảng so sánh để tóm tắt sự khác biệt giữa hai loại trái phiếu.
Bài viết này đơn giản hóa chủ đề nhưng dường như thiếu dữ liệu tham khảo nghiêm trọng. Độ tin cậy cao hơn có thể được đưa ra với các trích dẫn thích hợp
Tôi đồng ý. Tôi đã kiểm tra các tài liệu tham khảo được cung cấp và chúng là những nguồn đáng tin cậy.
Tôi thấy thông tin này rất hữu ích, đặc biệt cho kỳ thi hóa học sắp tới của tôi
Tác giả có vẻ rất am hiểu về Hóa học. Tôi thích đọc những bài viết chi tiết như thế này.
Đã đồng ý. Bảng so sánh rất hữu ích trong việc làm nổi bật sự khác biệt giữa liên kết ion và cộng hóa trị.
Bài viết giải thích các chủ đề rất hữu ích cho việc học nhập môn.
Bài đăng này cung cấp một cái nhìn tổng quan toàn diện về liên kết ion và cộng hóa trị. Các ví dụ rất hữu ích trong việc hiểu các khái niệm.
Thông tin đầy đủ có giá trị cho mục đích giáo dục. Một cuốn sách phải đọc dành cho học sinh trung học
Bảng so sánh là một cách tuyệt vời để minh họa sự khác biệt, đối với bất kỳ ai có kiến thức cơ bản về hóa học, bài viết này có thể là một nguồn tài liệu tuyệt vời
Tôi đồng ý. Những bài học quan trọng cũng khá hữu ích và đơn giản hóa các khái niệm.
Bài viết trình bày sự khác biệt giữa liên kết ion và cộng hóa trị một cách rõ ràng. Tôi tìm thấy nó rất hữu ích.