Hay muchas diferencias críticas entre un enlace covalente y uno de hidrocarburo. La química, el estudio de las sustancias, elementos y compuestos, comienza con los conceptos básicos de los enlaces entre dos átomos y moléculas.
Este artículo explicará las diferencias entre los enlaces de hidrógeno y covalentes y cómo se forman. Veremos los dos tipos de enlaces químicos. El tipo de interacción hace que una molécula covalente sea diferente de una molécula de hidrocarburo.
Puntos clave
- Los enlaces de hidrógeno se forman entre moléculas cuando un átomo de hidrógeno se une a un átomo altamente electronegativo; Los enlaces covalentes comparten electrones entre los átomos dentro de una molécula.
- Los enlaces de hidrógeno son más débiles que los enlaces covalentes, proporcionando interacciones temporales y reversibles.
- Los enlaces de hidrógeno contribuyen a la estructura y función de las moléculas biológicas; Los enlaces covalentes forman la base de las estructuras moleculares.
Enlace de hidrógeno vs enlace covalente
Los enlaces de hidrógeno surgen cuando un átomo de hidrógeno cargado positivamente interactúa con un átomo electronegativo, creando un enlace relativamente más débil que los enlaces covalentes que implican compartir electrones. Estos enlaces son esenciales para las propiedades únicas del agua. Los enlaces covalentes forman la base de la mayoría de las moléculas.

Un enlace de hidrógeno puede ser intramolecular o intermolecular. La energía asociada con un enlace de hidrógeno varía según la geometría y el entorno de los átomos.
Es un enlace más débil que la interacción de van der Waals, que ocurre en moléculas orgánicas e inorgánicas. Algunos ejemplos de enlaces de hidrógeno son el ácido salicílico, H2O (agua), alcohol metílico, azúcar, etc.
Los enlaces covalentes son formas de fuerzas intermoleculares. Se forman cuando dos o más átomos comparten sus electrones para llenar sus capas de electrones más externas. Los enlaces covalentes son mucho más fuertes que los enlaces de hidrógeno y tienen una alta estabilidad.
Tabla de comparación
| Parámetros de comparación | Enlace de hidrógeno | Enlace covalente |
|---|---|---|
| ¿Qué son? | Un enlace de hidrógeno es una fuerza de atracción entre un átomo de hidrógeno y un átomo más electronegativo. | Los enlaces covalentes son enlaces químicos formados al compartir electrones. |
| Fuerzas | Fuerzas intermoleculares e intramoleculares. | Fuerzas intermoleculares. |
| Fortalecimiento | Se forma entre dos átomos. | Los enlaces covalentes son mucho más fuertes en comparación con los enlaces de hidrógeno. |
| formado entre | Un enlace de hidrógeno se forma entre dos átomos de dos moléculas diferentes. | Formado entre dos átomos. |
| Ejemplos | Ácido salicílico, Agua, Glucosa, etc. | Metano, monóxido de carbono, etc. |
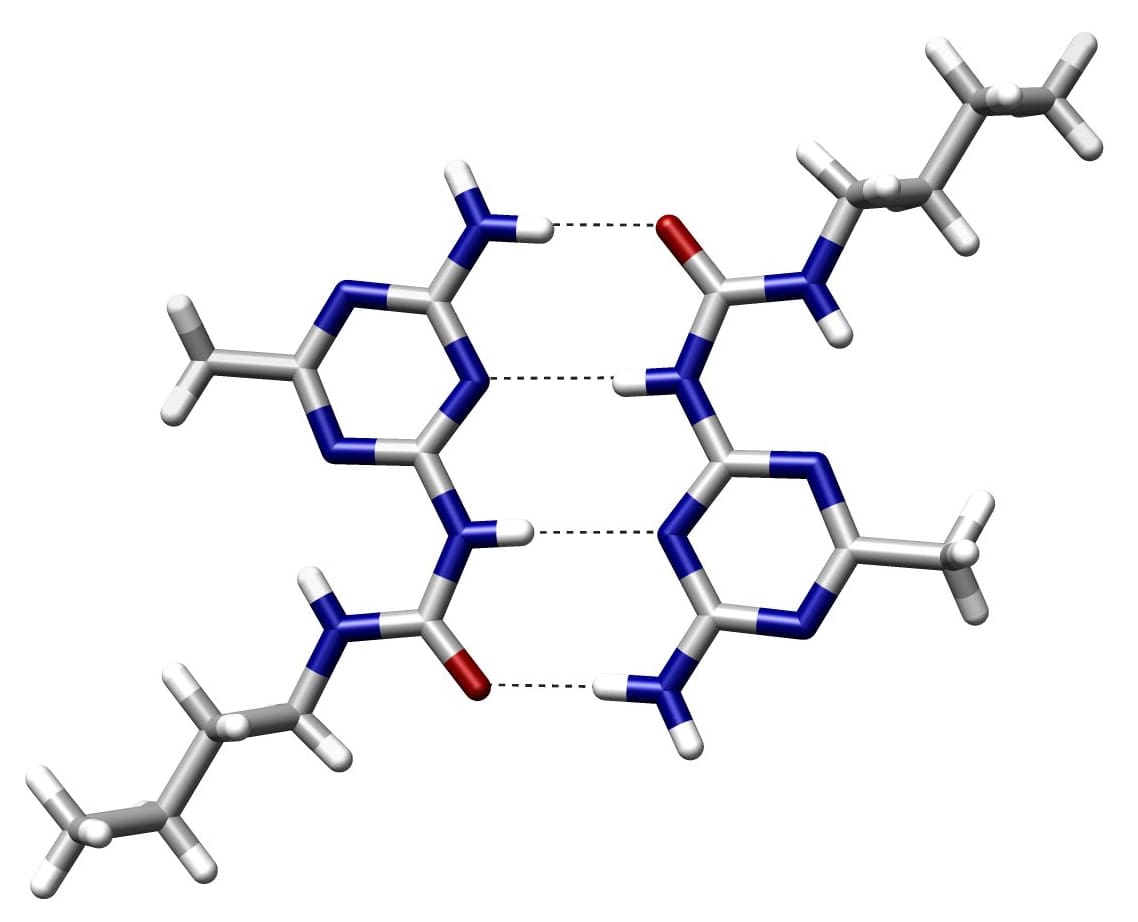
¿Qué es un enlace de hidrógeno?
Un enlace de hidrógeno es una fuerza eléctrica de atracción entre dos átomos. Se crea cuando un átomo de hidrógeno se une covalentemente con otro bit más electronegativo, como un octeto o un grupo.
En su mayoría, las moléculas electronegativas son oxígeno, nitrógeno o flúor. En la mayoría de los casos, un átomo más electronegativo con un solo par de electrones se llama aceptor.
Los enlaces de hidrógeno son fuertes atracciones entre átomos parcialmente positivos y cargados positivamente. Son los más fuertes de todos los tipos de enlaces conocidos. Estos enlaces se encuentran en muchos compuestos covalentes pero son más débiles que los covalentes.
La naturaleza electronegativa del átomo de hidrógeno une las dos moléculas. Por lo tanto, el agua puede moverse entre las partículas y formar compuestos químicos estables. Por ejemplo, cuando las hojas de papel mojadas se pegan.
Los enlaces de hidrógeno se producen entre dos moléculas que contienen el mismo tipo de hidrógeno.
Los enlaces CH se forman cuando dos átomos de carbono se vuelven electronegatividad Unido.
En un enlace donante/aceptor, el donante de protones es el átomo electronegativo, y el aceptor de protones es el que no está unido covalentemente con el hidrógeno. Los átomos de hidrógeno en el par de bases se mantienen unidos por enlaces de hidrógeno.
¿Qué es un enlace covalente?
Dos átomos comparten pares de electrones para formar un enlace covalente. Estos pares de electrones se denominan pares de enlace. Los enlaces covalentes se crean a través de un equilibrio de fuerzas atractivas y repulsivas.
Aquí hay unos ejemplos. Para ilustrar, aquí hay una ecuación química. Siga leyendo para descubrir la ciencia detrás de ellos. El ejemplo más simple de enlace covalente es compartir un par de electrones.
El proceso de enlace implica compartir electrones entre dos átomos diferentes. Debido a que los electrones comparten energía, pueden tener menor energía que los otros átomos. Se enredan cuando los centros se atraen entre sí.
“Los electrones compartidos disminuyen la energía del otro átomo. A esto se le llama “equilibrio”. Este fenómeno es común y puede usarse para seguir el progreso e identificar lecciones esenciales”. Los electrones compartidos disminuyen la energía del otro átomo. A esto se le llama “equilibrio”. Este fenómeno es común y se puede utilizar para seguir el progreso e identificar lecciones esenciales.
El proceso de compartir electrones da como resultado una disminución de la energía. El electrón que comparte un átomo con otro electrón perderá potencia. Es en este estado que se forma el enlace covalente.
Un electrón entre dos centros de atracción tiene menor energía que un electrón entre dos neutros. El poder de un solo átomo aumenta en una molécula si se comparte con un bit con un nivel de energía más alto.
Principales diferencias entre un enlace de hidrógeno y un enlace covalente
- Un enlace de hidrógeno es solo 1/10 veces más fuerte que un enlace covalente.
- Los enlaces de hidrógeno son enlaces intramoleculares e intermoleculares. Por otro lado, los enlaces covalentes son enlaces químicos intermoleculares.
- Los puentes de hidrógeno se forman entre dos átomos de dos moléculas diferentes. Los enlaces covalentes se forman entre dos átomos.
- Los puentes de hidrógeno son fuerzas de atracción. Los enlaces covalentes son enlaces químicos.
- Los enlaces de hidrógeno tienen poca estabilidad en comparación con los enlaces covalentes.
- https://scripts.iucr.org/cgi-bin/paper?a12816
- https://pubs.acs.org/doi/pdf/10.1021/ja01130a013
- https://aip.scitation.org/doi/abs/10.1063/1.3159673
Última actualización: 29 de junio de 2023

Piyush Yadav ha pasado los últimos 25 años trabajando como físico en la comunidad local. Es un físico apasionado por hacer que la ciencia sea más accesible para nuestros lectores. Tiene una licenciatura en Ciencias Naturales y un Diploma de Postgrado en Ciencias Ambientales. Puedes leer más sobre él en su página de biografía.

La explicación científica es clara y precisa. Esto me ha ayudado a entender mejor el concepto.
La comparación de los enlaces de hidrógeno y covalentes está bien explicada. ¡Buen artículo!
Sí, estoy completamente de acuerdo. Es beneficioso para estudiantes y otras personas interesadas en la química.
Este artículo proporciona un análisis en profundidad de las diferencias entre hidrógeno y enlaces covalentes.
El autor ha hecho un excelente trabajo al explicar los conceptos con ejemplos relevantes. Es digno de elogio.
Leer este artículo fue realmente enriquecedor. He obtenido ideas y conocimientos valiosos a partir de la comparación proporcionada aquí.
Esperaba un poco más de evidencia científica para respaldar algunos de los puntos mencionados. Bueno, pero no genial.