En Química, diferentes compuestos están formados por diferentes tipos de enlaces entre las moléculas.
Varios factores determinan qué tipo de enlace debe formarse entre diferentes moléculas, y el tipo de moléculas juega un papel muy importante en la formación de tales enlaces.
Un enlace es una fuerza de atracción que actúa entre dos moléculas.
Puntos clave
- Los enlaces iónicos se forman entre metales y no metales mediante la transferencia de electrones, mientras que los enlaces covalentes se forman entre no metales mediante el intercambio de electrones.
- Los compuestos iónicos tienen puntos de fusión y ebullición altos, mientras que los compuestos covalentes tienen puntos de fusión y ebullición más bajos.
- Los compuestos iónicos conducen la electricidad cuando se disuelven en agua o se derriten, pero los compuestos covalentes no.
Enlaces iónicos vs enlace covalente
Los enlaces iónicos se forman entre átomos a través de la transferencia de electrones, creando iones que se atraen entre sí debido a sus cargas opuestas. Los enlaces covalentes involucran el intercambio de electrones entre átomos, creando una atracción mutua que mantiene unidos a los átomos.
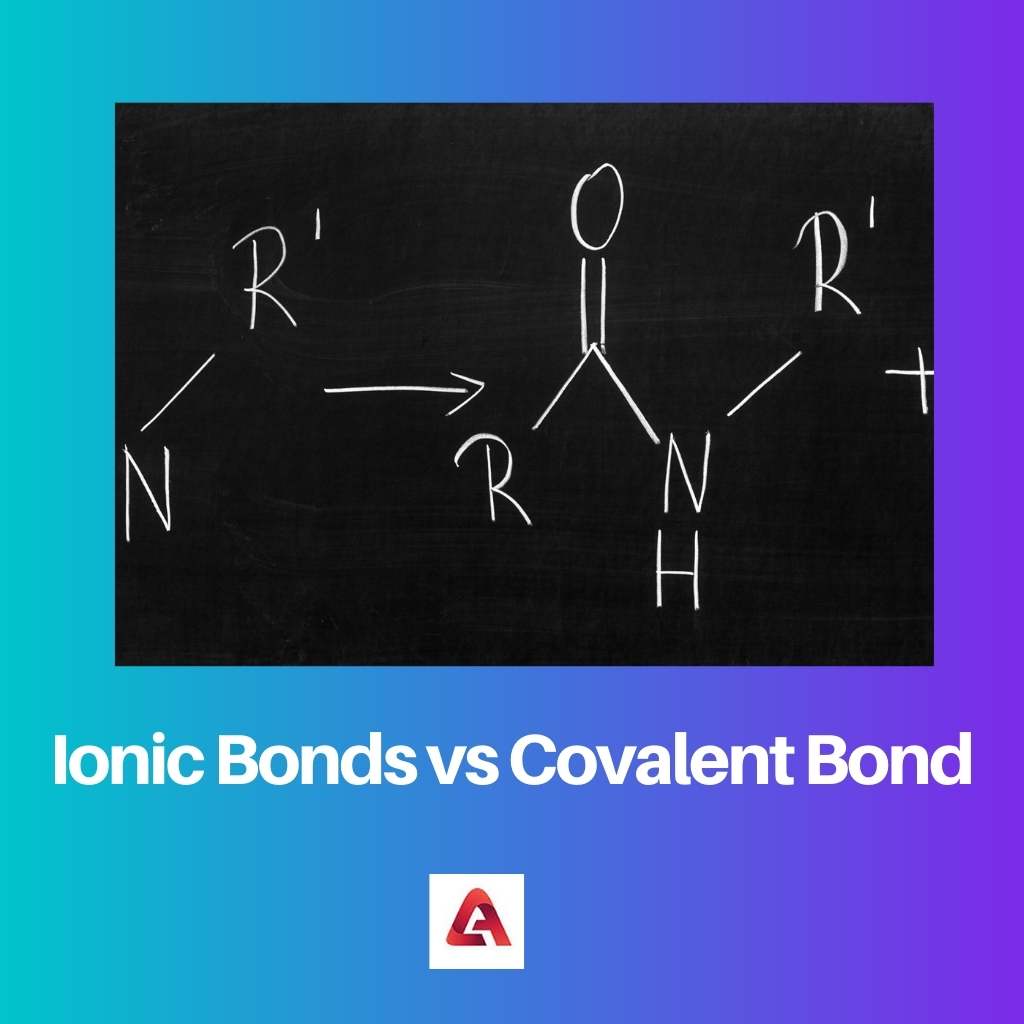
Se forma un enlace iónico en el caso de compuestos iónicos. Los compuestos iónicos están formados por moléculas que contienen iones cargados, que pueden tener carga positiva o negativa.
Por lo tanto, esto crea una fuerza de atracción entre las moléculas cuando las cargas opuestas se atraen entre sí. Esta fuerza de atracción da como resultado la formación del enlace.
Los enlaces covalentes se forman entre no metales. Este tipo de enlace se forma debido al intercambio de electrones entre dos moléculas.
Como una de las moléculas en un compuesto covalente es deficiente en electrones, recibe el número requerido de electrones de las moléculas donantes para crear un compuesto covalente estable.
Tabla de comparación
| Parámetros de comparación | Enlace iónico | Enlace covalente |
|---|---|---|
| contenido SEO | Los enlaces iónicos se forman debido a la transferencia de iones entre moléculas. | Los enlaces covalentes se forman debido al intercambio de electrones entre dos moléculas. |
| Estado del compuesto | Los compuestos formados están presentes solo en estado sólido. | Los compuestos formados están presentes en todos los estados de la materia. |
| Tipo de moléculas | El enlace se da entre un metal y un no metal | El enlace se produce entre dos no metales. |
| Polaridad | Los compuestos iónicos son no polares. | Los compuestos covalentes son polares. |
| punto de fusión | Los compuestos iónicos tienen puntos de fusión más altos. | Los compuestos covalentes tienen puntos de fusión más bajos. |
¿Qué es el enlace iónico?
Un enlace iónico es uno de los tres tipos de enlaces que se dan entre moléculas, formando un compuesto iónico.
El enlace se produce entre un metal y un no metal, y uno de los ejemplos más comunes de dicho compuesto es la sal (NaCl), en la que el sodio (Na) es un metal y el cloro (Cl) es un no metal.
Es un enlace fuerte y no se puede romper tan fácilmente como en el caso de los enlaces covalentes. El enlace se produce debido a un intercambio de electrones entre el metal y el no metal.
Una de las moléculas en un compuesto iónico es deficiente en electrones, mientras que la otra molécula es rica en electrones, creando una fuerza de atracción entre las dos moléculas.
La fuerza de atracción electrostática da como resultado la interacción entre las dos moléculas, compartiendo electrones desde el átomo rico en electrones hasta el átomo deficiente en electrones.
El átomo o molécula donante transfiere completamente el átomo a la molécula o átomo receptor, lo que da como resultado un enlace fuerte y limpio entre las dos moléculas.
Las características de tales compuestos iónicos son sus altos puntos de fusión y alta conductividad eléctrica en estado fundido o disuelto. Los compuestos iónicos también son altamente solubles en agua.

¿Qué es el enlace covalente?
Un enlace covalente es un tipo de enlace químico entre moléculas que conduce a la formación de un compuesto covalente.
Es el más débil de los tres tipos de enlaces químicos, y las moléculas de un compuesto covalente se pueden separar fácilmente.
Los enlaces covalentes se forman entre dos no metales, y el enlace de los metales de las moléculas depende del número de electrones de la capa de valencia.
El enlace se produce al compartir pares de electrones, y este intercambio de electrones se produce para mantener el equilibrio químico entre las moléculas o los átomos.
El intercambio de electrones entre dos moléculas inestables crea una capa de valencia estable en ambas moléculas.
Cuando ambos átomos han alcanzado su estado de valencia total, se forma un enlace entre los dos átomos o moléculas.
El par de electrones compartido está presente entre ambos átomos para mantener la estabilidad del compuesto.
El ejemplo más común de un enlace covalente es entre los dos átomos de hidrógeno en una molécula de H2.
En una molécula de H2, los dos átomos de hidrógeno comparten dos electrones que conducen a un enlace covalente.
El factor clave requerido para la formación de un enlace covalente son las electronegatividades de las moléculas. Dos átomos con electronegatividades similares dan como resultado un enlace covalente.

Principales diferencias entre enlace iónico y covalente
- Los enlaces iónicos se forman debido a la transferencia de iones entre moléculas. Los enlaces covalentes se forman debido al intercambio de electrones entre átomos.
- Los compuestos iónicos solo están presentes en estado sólido. Compuestos covalentes están presentes en todos los estados de la materia.
- Un enlace iónico se forma entre un metal y un no metal. Un enlace covalente se forma entre dos no metales.
- Los compuestos iónicos son no polares, mientras que los compuestos covalentes son polares.
- Los compuestos iónicos tienen puntos de fusión muy altos, mientras que los compuestos covalentes tienen puntos de fusión bajos.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Última actualización: 14 de junio de 2023

Piyush Yadav ha pasado los últimos 25 años trabajando como físico en la comunidad local. Es un físico apasionado por hacer que la ciencia sea más accesible para nuestros lectores. Tiene una licenciatura en Ciencias Naturales y un Diploma de Postgrado en Ciencias Ambientales. Puedes leer más sobre él en su página de biografía.

Información fascinante sobre los enlaces iónicos y covalentes, la cantidad de información detallada en el artículo es notable y muy fácil de entender.
Artículo interesante. Agradezco la discusión en profundidad sobre las características de los compuestos iónicos y covalentes.
No estoy de acuerdo. Los enlaces covalentes no son necesariamente los más débiles de los tres tipos de enlaces químicos. Hay casos en los que son más fuertes que los enlaces iónicos.
Eso es cierto en determinadas circunstancias, pero en general la afirmación es válida. Los enlaces covalentes se consideran los más débiles debido a la facilidad para romperlos.
Excelente explicación sobre enlaces iónicos y covalentes. Espero leer más de este autor.
Sí, la publicación fue muy informativa y fácil de entender. Agradezco la tabla comparativa para resumir las diferencias entre los dos tipos de bonos.
Este artículo simplifica el tema, pero parece haber una grave falta de referencias a datos. Se puede dar más credibilidad con citas adecuadas.
Estoy de acuerdo. Revisé las referencias proporcionadas y son fuentes creíbles.
La información me resultó muy útil, especialmente para mi próximo examen de química.
El autor parece tener mucho conocimiento en materia de química. Disfruto leyendo publicaciones detalladas como esta.
Acordado. La tabla de comparación es muy útil para resaltar las distinciones entre enlaces iónicos y covalentes.
El artículo explica los temas que son muy útiles para el aprendizaje introductorio.
Esta publicación proporciona una descripción general completa de los enlaces iónicos y covalentes. Los ejemplos son muy útiles para comprender los conceptos.
Información adecuada y valiosa para fines educativos. Una lectura obligada para estudiantes de secundaria.
La tabla comparativa es una excelente manera de ilustrar las diferencias; para cualquiera con conocimientos básicos de química, este artículo podría ser un recurso maravilloso.
Estoy de acuerdo. Las conclusiones clave también son bastante útiles y simplifican los conceptos.
El artículo presenta claramente las diferencias entre enlaces iónicos y covalentes. Lo encontré muy útil.