Есть много критических различий между ковалентной и углеводородной связью. Химия, изучение веществ – элементов и соединений, начинается с основ связей между двумя атомами и молекулами.
В этой статье объясняются различия между водородными и ковалентными связями и то, как они образуются. Мы рассмотрим два типа химических связей. Тип взаимодействия отличает ковалентную молекулу от молекулы углеводорода.
Основные выводы
- Водородные связи образуются между молекулами, когда атом водорода связывается с сильно электроотрицательным атомом; ковалентные связи разделяют электроны между атомами внутри молекулы.
- Водородные связи слабее ковалентных, обеспечивая временные и обратимые взаимодействия.
- Водородные связи вносят вклад в структуру и функции биологических молекул; ковалентные связи составляют основу молекулярных структур.
Водородная связь против ковалентной связи
Водородные связи возникают, когда положительно заряженный атом водорода взаимодействует с электроотрицательным атомом, создавая относительно более слабую связь, чем ковалентные связи, которые включают совместное использование электронов. Эти связи необходимы для уникальных свойств воды. Ковалентные связи составляют основу большинства молекул.

Водородная связь может быть как внутримолекулярной, так и межмолекулярной. Энергия, связанная с водородной связью, варьируется в зависимости от геометрии и окружения атомов.
Это более слабая связь, чем взаимодействие Ван-дер-Ваальса, возникающее в органических и неорганических молекулах. Некоторыми примерами водородной связи являются салициловая кислота, H2O (вода), метиловый спирт, сахар и т. д.
Ковалентные связи являются формой межмолекулярных сил. Они образуются, когда два или более атома делят свои электроны, чтобы заполнить свои внешние электронные оболочки. Ковалентные связи намного прочнее водородных и обладают высокой стабильностью.
Сравнительная таблица
| Параметры сравнения | Водородная связь | Ковалентная связь |
|---|---|---|
| Кто они такие? | Водородная связь — это сила притяжения между атомом водорода и более электроотрицательным атомом. | Ковалентные связи — это химические связи, образованные за счет совместного использования электронов. |
| Войска | Межмолекулярные и внутримолекулярные силы. | Межмолекулярные силы. |
| Силы | Он образуется между двумя атомами. | Ковалентные связи намного прочнее водородных. |
| Сформированный между | Водородная связь образуется между двумя атомами двух разных молекул. | Образуется между двумя атомами. |
| Примеры | Салициловая кислота, вода, глюкоза и др. | Метан, угарный газ и др. |
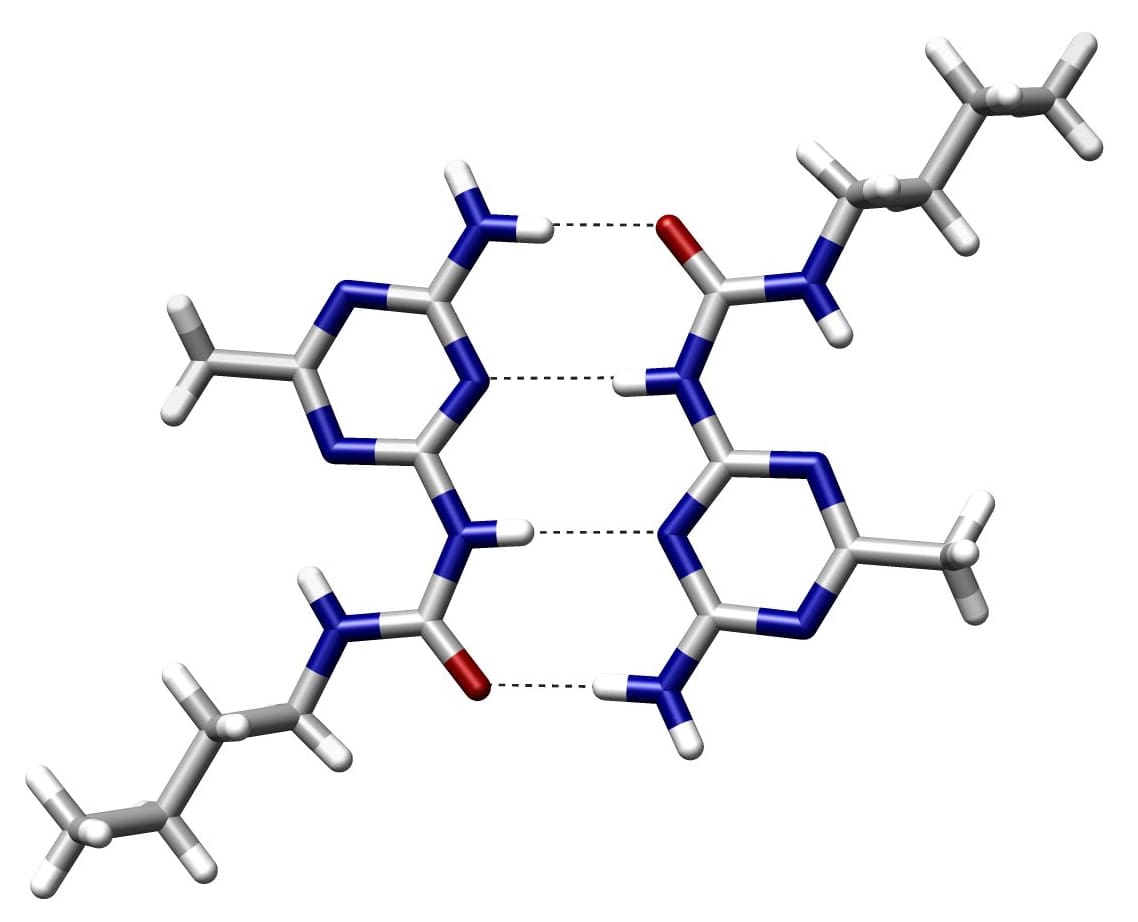
Что такое водородная связь?
Водородная связь представляет собой электрическую силу притяжения между двумя атомами. Он создается, когда атом водорода ковалентно связывается с другим более электроотрицательным битом, таким как октет или группа.
В основном электроотрицательными молекулами являются кислород, азот или фтор. В большинстве случаев акцептором называют более электроотрицательный атом с неподеленной парой электронов.
Водородные связи — это сильное притяжение между частично положительными и положительно заряженными атомами. Они являются самыми прочными из всех известных типов связей. Эти связи встречаются во многих ковалентные соединения но они слабее ковалентных.
Электроотрицательная природа атома водорода связывает две молекулы вместе. Поэтому вода может перемещаться между частицами и образовывать стабильные химические соединения. Например, когда мокрые бумажные листы слипаются.
Водородные связи возникают между двумя молекулами, содержащими один и тот же тип водорода.
Связи CH образуются, когда два атома углерода становятся электроотрицательность граница.
В донорно-акцепторной связи донором протона является электроотрицательный атом, а акцептором протона является тот, который не связан ковалентно с водородом. Атомы водорода в паре оснований удерживаются вместе водородными связями.
Что такое ковалентная связь?
Два атома имеют общие электронные пары, образуя ковалентную связь. Эти электронные пары называются связывающими парами. Ковалентные связи создаются за счет баланса сил притяжения и отталкивания.
Вот некоторые примеры. Для иллюстрации приведем химическое уравнение. Читайте дальше, чтобы открыть для себя науку, стоящую за ними. Простейшим примером ковалентной связи является общая пара электронов.
Процесс связывания включает в себя обмен электронами между двумя разными атомами. Поскольку электроны разделяют энергию, они могут иметь меньшую энергию, чем другие атомы. Они запутываются, когда центры притягиваются друг к другу.
«Общие электроны уменьшают энергию другого атома. Это называется «равновесие». Это распространенное явление, и его можно использовать для отслеживания прогресса и извлечения важных уроков. «Общие электроны уменьшают энергию другого атома. Это называется «равновесие». Это распространенное явление, и его можно использовать для отслеживания прогресса и извлечения важных уроков.
Процесс обмена электронами приводит к уменьшению энергии. Электрон, который делит атом с другим электроном, теряет энергию. Именно в этом состоянии образуется ковалентная связь.
Электрон между двумя притягивающими центрами имеет меньшую энергию, чем электрон между двумя нейтральными. Мощность отдельного атома в молекуле увеличивается, если он делится с частицей с более высоким уровнем энергии.
Основные различия между водородной связью и ковалентной связью
- Водородная связь всего в 1/10 раз прочнее ковалентной связи.
- Водородные связи – это внутримолекулярные и межмолекулярные связи. С другой стороны, ковалентные связи представляют собой межмолекулярные химические связи.
- Водородные связи образуются между двумя атомами двух разных молекул. Ковалентные связи образуются между двумя атомами.
- Водородные связи являются силами притяжения. Ковалентные связи – это химические связи.
- Водородные связи обладают меньшей стабильностью по сравнению с ковалентными связями.
- https://scripts.iucr.org/cgi-bin/paper?a12816
- https://pubs.acs.org/doi/pdf/10.1021/ja01130a013
- https://aip.scitation.org/doi/abs/10.1063/1.3159673
Последнее обновление: 29 июня 2023 г.

Пиюш Ядав последние 25 лет работал физиком в местном сообществе. Он физик, увлеченный тем, чтобы сделать науку более доступной для наших читателей. Он имеет степень бакалавра естественных наук и диплом о высшем образовании в области наук об окружающей среде. Подробнее о нем можно прочитать на его био страница.

Научное объяснение ясно и точно. Это помогло мне лучше понять концепцию.
Хорошо объясняется сравнение водородных и ковалентных связей. Отличная статья!
Да, я полностью согласен. Это полезно для студентов и всех, кто интересуется химией.
В этой статье представлен углубленный анализ различий между водородными и ковалентными связями.
Автор проделал отличную работу по объяснению концепций на соответствующих примерах. Это похвально.
Чтение этой статьи было действительно полезным. Я получил ценную информацию и знания из приведенного здесь сравнения.
Я ожидал немного больше научных доказательств, подтверждающих некоторые из упомянутых пунктов. Хорошо, но не отлично.