В химии разные соединения образуются за счет разных типов связей между молекулами.
Различные факторы определяют, какой тип связи должен образовываться между разными молекулами, и тип молекул играет огромную роль в образовании таких связей.
Связь – это сила притяжения, действующая между двумя молекулами.
Основные выводы
- Ионные связи образуются между металлами и неметаллами за счет переноса электронов, а ковалентные связи образуются между неметаллами за счет обмена электронами.
- Ионные соединения имеют высокие температуры плавления и кипения, тогда как ковалентные соединения имеют более низкие температуры плавления и кипения.
- Ионные соединения проводят электричество при растворении в воде или в расплавленном состоянии, а ковалентные соединения - нет.
Ионные связи против ковалентной связи
Ионные связи образуются между атомами за счет переноса электронов, создавая ионы, которые притягиваются друг к другу из-за их противоположных зарядов. Ковалентные связи включают совместное использование электронов между атомами, создавая взаимное притяжение, которое удерживает атомы вместе.
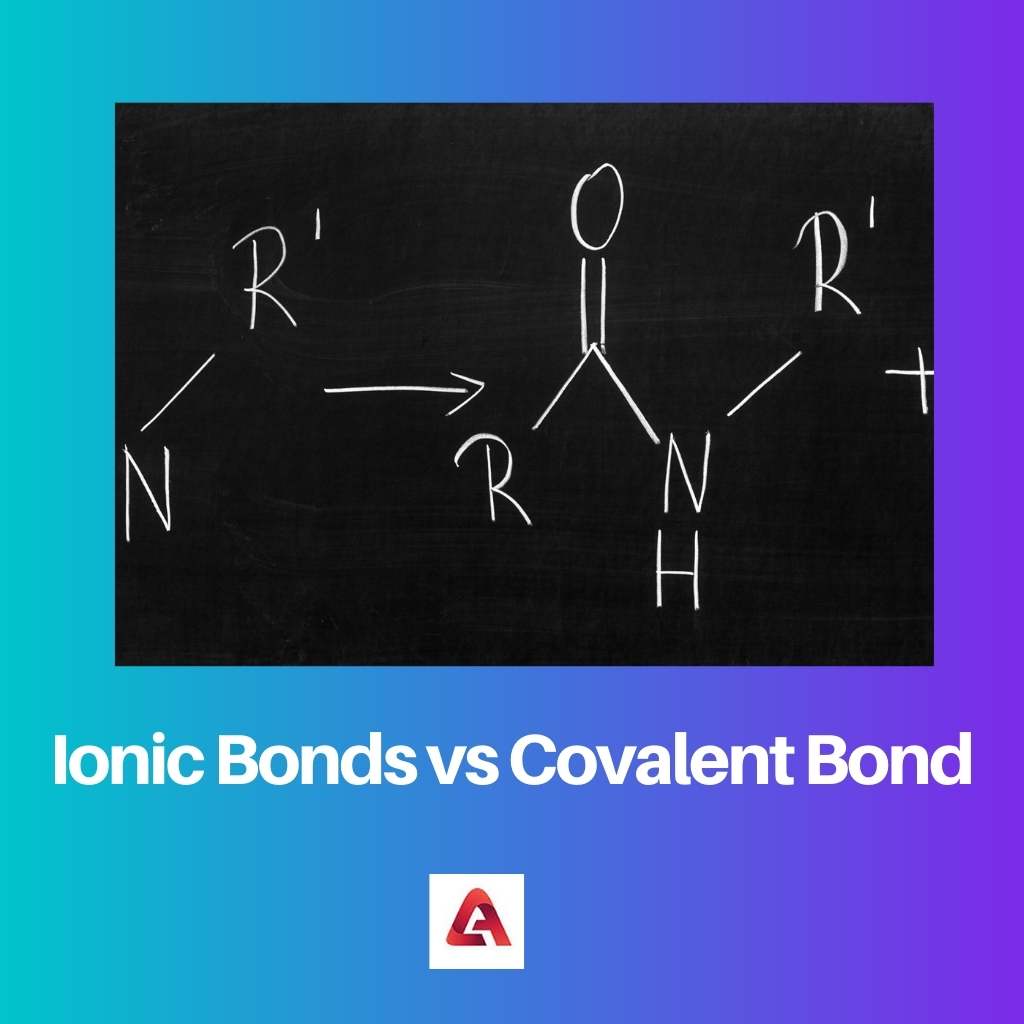
Ионная связь образуется в случае ионных соединений. Ионные соединения состоят из молекул, содержащих заряженные ионы, которые могут быть как положительно, так и отрицательно заряженными.
Таким образом, это создает силу притяжения между молекулами, поскольку противоположные заряды притягиваются друг к другу. Эта сила притяжения приводит к образованию связи.
Ковалентные связи образуются между неметаллами. Этот тип связи образуется за счет совместного использования электронов между двумя молекулами.
Поскольку одной из молекул в ковалентном соединении недостает электронов, она получает необходимое количество электронов от молекул-доноров для создания стабильного ковалентного соединения.
Сравнительная таблица
| Параметры сравнения | Ионная связь | Ковалентная связь |
|---|---|---|
| Создание | Ионные связи образуются за счет переноса ионов между молекулами | Ковалентные связи образуются за счет обмена электронами между двумя молекулами. |
| Состояние соединения | Образующиеся соединения находятся только в твердом состоянии. | Образующиеся соединения находятся во всех агрегатных состояниях. |
| Тип молекул | Соединение происходит между металлом и неметаллом | Связь возникает между двумя неметаллами |
| Полярность | Ионные соединения неполярны. | Ковалентные соединения полярны. |
| Температура плавления | Ионные соединения имеют более высокую температуру плавления. | Ковалентные соединения имеют более низкую температуру плавления. |
Что такое ионная связь?
Ионная связь — это один из трех типов связей, возникающих между молекулами, образующих ионное соединение.
Связь возникает между металлом и неметаллом, и одним из наиболее распространенных примеров такого соединения является соль (NaCl), в которой натрий (Na) является металлом, а хлор (Cl) является неметаллом.
Это прочная связь, и ее нельзя разорвать так же легко, как в случае ковалентной связи. Связь возникает из-за обмена электронами между металлом и неметаллом.
Одна из молекул в ионном соединении имеет дефицит электронов, а другая молекула богата электронами, что создает силу притяжения между двумя молекулами.
Электростатическая сила притяжения приводит к взаимодействию между двумя молекулами, разделяющему электроны от атома, богатого электронами, к атому с дефицитом электронов.
Атом или молекула-донор полностью переносит атом к молекуле или атому-приемнику, в результате чего между двумя молекулами образуется прочная и чистая связь.
Характерными чертами таких ионных соединений являются их высокие температуры плавления и высокая электропроводность в расплавленном или растворенном состоянии. Ионные соединения также хорошо растворяются в воде.

Что такое ковалентная связь?
Ковалентная связь — это тип химической связи между молекулами, который приводит к образованию ковалентного соединения.
Это самый слабый из трех типов химических связей, и молекулы в ковалентном соединении легко разделяются.
Ковалентные связи образуются между двумя неметаллами, а связывание молекул металлов зависит от количества электронов валентной оболочки.
Связывание происходит за счет совместного использования электронных пар, и это совместное использование электронов происходит для поддержания химического баланса между молекулами или атомами.
Разделение электронов между двумя нестабильными молекулами создает стабильную валентную оболочку в обеих молекулах.
Когда оба атома достигают своего состояния полной валентности, между двумя атомами или молекулами образуется связь.
Общая пара электронов присутствует между обоими атомами для поддержания стабильности соединения.
Наиболее распространенным примером ковалентной связи является связь между двумя атомами водорода в молекуле H2.
В молекуле H2 два атома водорода имеют два общих электрона, что приводит к ковалентной связи.
Ключевым фактором, необходимым для образования ковалентной связи, является электроотрицательность молекул. Два атома с одинаковой электроотрицательностью образуют ковалентную связь.

Основные различия между ионной и ковалентной связью
- Ионные связи образуются за счет переноса ионов между молекулами. Ковалентные связи образуются за счет обмена электронами между атомами.
- Ионные соединения существуют только в твердом состоянии. Ковалентные соединения присутствуют во всех состояниях вещества.
- Ионная связь образуется между металлом и неметаллом. Ковалентная связь образуется между двумя неметаллами.
- Ионные соединения неполярны, тогда как ковалентные соединения полярны.
- Ионные соединения имеют очень высокие температуры плавления, тогда как ковалентные соединения имеют низкую температуру плавления.
- https://link.springer.com/article/10.1007/s00214-007-0282-x
- https://journals.aps.org/pr/abstract/10.1103/PhysRev.168.905
Последнее обновление: 14 июня 2023 г.

Пиюш Ядав последние 25 лет работал физиком в местном сообществе. Он физик, увлеченный тем, чтобы сделать науку более доступной для наших читателей. Он имеет степень бакалавра естественных наук и диплом о высшем образовании в области наук об окружающей среде. Подробнее о нем можно прочитать на его био страница.

Увлекательная информация об ионных и ковалентных связях, объем информации, подробно изложенной в статье, поразителен и очень прост для понимания.
Интересная статья. Я ценю углубленное обсуждение характеристик ионных и ковалентных соединений.
Я не согласен. Ковалентные связи не обязательно являются самыми слабыми из трех типов химических связей. Бывают случаи, когда они сильнее ионных связей.
Это верно в определенных обстоятельствах, но в целом это утверждение справедливо. Ковалентные связи считаются самыми слабыми из-за легкости разрыва связи.
Отличное объяснение ионных и ковалентных связей. С нетерпением жду продолжения от этого автора.
Да, пост очень информативный и простой для понимания. Я ценю сравнительную таблицу, в которой суммируются различия между двумя типами облигаций.
Эта статья упрощает тему, но, похоже, существует серьезная нехватка ссылок на данные. Больше доверия можно обеспечить правильными цитатами.
Я согласен. Я проверил предоставленные ссылки, и они являются надежными источниками.
Информация оказалась очень полезной, особенно для предстоящего экзамена по химии.
Автор, судя по всему, очень хорошо разбирается в химии. Мне нравится читать такие подробные посты, как этот.
Согласованный. Сравнительная таблица очень полезна для выявления различий между ионными и ковалентными связями.
В статье объясняются темы, которые очень полезны для вводного обучения.
В этом посте представлен полный обзор ионных и ковалентных связей. Примеры очень полезны для понимания концепций.
Адекватная информация, ценная для образовательных целей. Обязательно к прочтению старшеклассникам
Сравнительная таблица — отличный способ проиллюстрировать различия. Для любого, у кого есть базовые знания в области химии, эта статья может стать прекрасным ресурсом.
Я согласен. Ключевые выводы также весьма полезны и упрощают концепции.
В статье наглядно представлены различия между ионной и ковалентной связью. Я нахожу это очень полезным.